
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 澄清石灰水跟过量CO2气体反应:Ca(OH)2+CO2=CaCO3↓+H2O
B. 稀硫酸与Cu反应:2H++Cu=Cu2++H2↑
C. 腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+
D. 铁粉加入AgNO3溶液中:Fe+Ag+=Fe2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
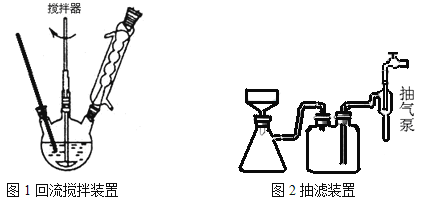
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
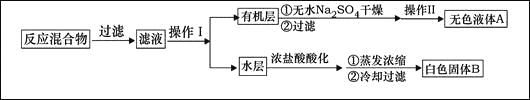
(1)无色液体A的结构简式为 。操作Ⅱspan>为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.有些活泼金属如铝可作还原剂法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A对氢气的相对密度为29,燃烧该有机物2.9克,生成3.36L(STP)二氧化碳。
(1)求该有机物的分子式;
(2)取0.58克该有机物与足量的银氨溶液反应,析出金属银2.16克。写出该化合物的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.![]()
C.c(H+)·c(OH-)
D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。

(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的氮氧化物(NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气污染。在25℃, 101kPa下,1molO3与烟气中的NO完全反应生成NO2,同时放热317.3kJ。请计算:
(1)标准状况下,1m3烟气中含NO 0.224L,要处理3 m3烟气中的NO,需O3的体积。
(2)上述 O3与NO在25℃,101kPa下,完全反应时产生的热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com