
【题目】某有机物A对氢气的相对密度为29,燃烧该有机物2.9克,生成3.36L(STP)二氧化碳。
(1)求该有机物的分子式;
(2)取0.58克该有机物与足量的银氨溶液反应,析出金属银2.16克。写出该化合物的结构简式。
【答案】
(1) C3H6O;
(2) CH3CH2CHO
【解析】
试题分析:(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,燃烧该有机物2.9g,生成3.36L二氧化碳气体(标况下)、2.7g水,则二氧化碳物质的量=![]() =0.15mol,水的物质的量=
=0.15mol,水的物质的量=![]() =0.15mol,则m(C)+m(H)=0.15mol×12g/mol+0.15mol×2×1g/mol=2.1g<2.9g,故m(O)=2.9g-2.1g=0.8g,n(O)=
=0.15mol,则m(C)+m(H)=0.15mol×12g/mol+0.15mol×2×1g/mol=2.1g<2.9g,故m(O)=2.9g-2.1g=0.8g,n(O)=![]() =0.05mol,故有机物A中C、H、O原子数目之比=0.15mol:0.15mol×2:0.05mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,答:有机物A的分子式为C3H6O;
=0.05mol,故有机物A中C、H、O原子数目之比=0.15mol:0.15mol×2:0.05mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,答:有机物A的分子式为C3H6O;
(2)0.58g该有机物的物质的量=![]() =0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=
=0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=![]() =0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,故答案为:CH3CH2CHO。
=0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,故答案为:CH3CH2CHO。


科目:高中化学 来源: 题型:
【题目】有下列物品或设备:
①陶瓷餐具 ②砖瓦③水泥路桥 ④门窗玻璃⑤水晶镜片 ⑥石英钟表⑦玛瑙手镯 ⑧硅太阳电池⑨光导纤维 ⑩计算机芯片
(1)用到硅单质的是 .
(2)所用材料为SiO2或要用到SiO2的是
(3)所用材料为硅酸盐的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/L NaOH溶液稀释到500ml,稀释后取出5ml,则溶液中NaOH的物质的量浓度为 ( )
A. 0.03mol/L B. 0.3mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制高能量电池,已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法
B.热还原法
C.热分解法
D.铅热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
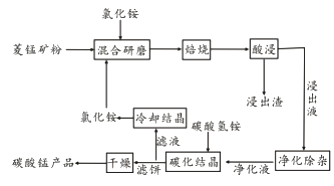
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
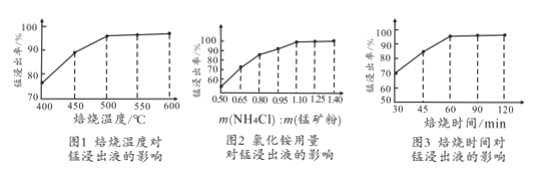
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组的同学们利用下图装置,探究不同条件对铁与酸反应速率的影响。

请回答下列问题。
(1)铁与稀硫酸反应的离子方程式是_______________________________________。
(2)适当升高烧瓶内液体的温度,产生气泡的速率将__________(填“加快、”“减慢”或“不变”),由此得出的结论是______________________________________________。
(3)将稀硫酸换为浓硫酸,可观察到_______________,原因是_________________。
(4)向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快。这是什么原因?
甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用。
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快。
你同意_______的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量_____,观察现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A.5∶3
B.5∶4
C.1∶1
D.3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com