
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
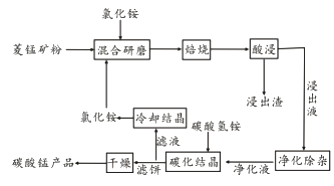
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
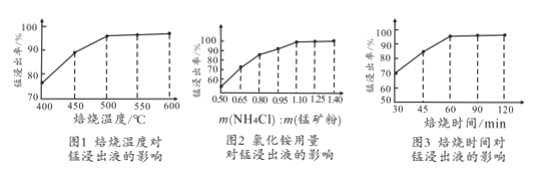
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
【答案】坩埚500℃1.10∶1(或1.10/1.1∶1、1.1)60min4.7≤pH<8.8Mn2++2HCO3-=MnCO3↓+CO2↑+H2ONH4Cl6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O95.8%或0.958
【解析】(1)实验室固体“焙烧”通常在坩埚中进行;
(2)随着温度的升高,锰浸出率逐渐升高,但是500℃以后,锰浸出率增加缓慢,并且在500℃时,锰浸出率已经达到95%以上,从节约能源的角度考虑,焙烧温度取500℃即可;当氯化铵与锰矿粉质量比为1.1:1时,锰浸出率已经达到95.8%,继续增加氯化铵用量,锰浸出率提高不明显,因此,选择氯化铵与锰矿粉质量比为1.1:1;焙烧时间为1h时锰浸出率达到最大,超过1h锰浸出率趋于平缓,因此,实验选择适宜的焙烧时间为1h;
(3)在80℃~90℃时,加入MnO2将Fe2+氧化为Fe3+,调节溶液的pH在“4.7≤pH<8.8”,水解沉淀Fe3+,此时Al3+也水解为Al(OH)3沉淀;
(4)“碳化结晶”时,加入碳酸氢铵是HCO3-的电离促进Mn2+生成MnCO3溶液,同时HCO3-与电离出的H+结合成水和CO2,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)“碳化结晶”时副产物为NH4Cl,可作为原料循环使用;
(6)①Fe2+有还原性,能被酸性K2Cr2O7溶液氧化为Fe3+,同时K2Cr2O7被还原为Cr3+,发生反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
K2Cr2O7的物质的量为1.00 mol·L-1×0.01L=0.01 mol,过量Fe2+的物质的量为0.01 mol×6=0.06mol,则与[Mn(PO4)2]3-反应的Fe2+的物质的量为2.00 mol·L-1×0.1L-0.06mol =0.14 mol,根据Mn2+~[Mn(PO4)2]3-~Fe2+,可知Mn2+的物质的量为,则样品中碳酸锰的质量分数为(0.14mol×115g/mol)÷16.80g×100%=95.8%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在饱和Mg(OH)2溶液中,c(OH-)=1.0×10-4 mol·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将
A.变为原来的10-3倍 B.变为原来的10-2倍
C.变为原来的10倍 D.不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积都为1 L,pH 都等于2 的盐酸和醋酸溶液中,投入0.65 g 锌粒,则下图所示比较符合客观事实的是
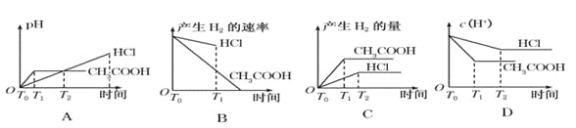
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A对氢气的相对密度为29,燃烧该有机物2.9克,生成3.36L(STP)二氧化碳。
(1)求该有机物的分子式;
(2)取0.58克该有机物与足量的银氨溶液反应,析出金属银2.16克。写出该化合物的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com