
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
科目:高中化学 来源: 题型:
【题目】在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、M均为中学化学常见物质,它们的转化关系如下图所示(部分生成物和反应条件略去)。A与水的反应在常温下进行。下列推断不正确的是( )
A. 若A为淡黄色固体,则D可能为CO
B. 若M为可溶性铝盐,则D可能为白色沉淀,且M(D)=M(A)
C. 若D为小苏打,C转化为D的反应是CO2+H2O+CO32-=2HCO3-,则A可能为氯气
D. 若C为CO2,则A一定为化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.![]()
C.c(H+)·c(OH-)
D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。

(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对元素周期律和元素周期表的认识正确的是( )
A. 元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B. 核外电子排布的周期性变化是元素性质周期性变化的本质
C. 元素周期表中可以把元素分成s、p、d、ds四个区
D. 元素周期表中最外层电子数<2的元素一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池。下图为碱性氢氧燃料电池结构示意图。
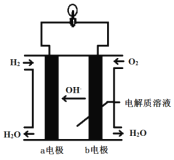
请回答下列问题。
(1)电池是将化学能直接转化为_________能的装置。
(2)氢氧燃料电池中发生反应的化学方程式是____________________。作为碱性氢氧燃料电池,该电池的电解质溶液可以是____________。
(3)b 电极上的反应为O2+2H2O+4e-![]() 4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
(4)氢氧燃料电池与普通电池相比,其优点是__________________(答出一点即可)。但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为_____能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:

已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中![]() 等于_________________
等于_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B. Al2O3熔点高,可用于制作耐高温仪器
C. 明矾能水解生成Al(OH)3胶体,可用作净水剂
D. SiO2有导电性,可用于制备光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com