
【题目】下列对元素周期律和元素周期表的认识正确的是( )
A. 元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B. 核外电子排布的周期性变化是元素性质周期性变化的本质
C. 元素周期表中可以把元素分成s、p、d、ds四个区
D. 元素周期表中最外层电子数<2的元素一定是金属元素
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁红、单质硫时,原料的综合利用率较高,其主要流程如图所示(己知Na[CuCl2]的电离方程式为:Na[CuCl2]=Na++[CuCl2]-):
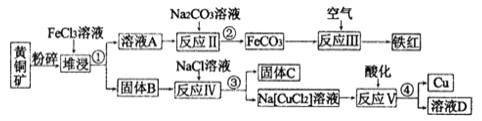
(1)流程中粉碎的目的是_____________,操作①、②、③、④的目的相同,在实验中这种操作的名称是____________。
(2)铁红的重要用途:__________________,固体B中含有两种产物,一种是单质C、另一种是原子个数比为1:l 的一种金属的低价态盐,写出堆浸时反应的化学方程式:________。
(3)反应V的离子方程式:___________________。
(4)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如图所示的装置进行电解精炼,则乙中溶液的溶质是_________,e电极上的电极反应式为_____。
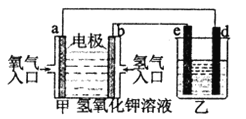
若当电路中有2mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为(假设杂质只有铁且精炼时铜与铁的放电比例与混合物比例相同,计算时用%表示保留一位小数)____________(已知相对原子质量:Fe 56 Cu 64 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有体现“结构决定性质”的事实是
A. 丙烷的沸点比甲烷高
B. 金刚石比石墨更硬
C. 乙烯可以使溴水褪色,而乙烷不能
D. 金属钠比镁更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
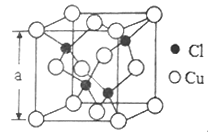
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868gcm-3的氨水。 (1)该气体的物质的量=_______mol;所得氨水的物质的量浓度= _______molL-1。 (2)若取上述氨水30.0mL与70.0mL2.00molL-1的AlCl3溶液相混合,产生白色沉淀的质量是___________g。
(3)若取一定体积浓度为5.00molL-1的NaOH溶液与50.0mL2.00molL-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,则NaOH溶液的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届浙江省名校协作体高三下学期】
恒温恒容装置中发生如下反应:A(g)+2B(g)![]() 2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
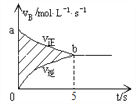
A. 反应放出的热量一定小于a kJ
B. 5s后,反应停止,各物质浓度保持不变
C. 5s末,ν(A)︰ν(B)=1︰2
D. 阴影部分面积可以表示A的物质的量浓度减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列说法正确的是( )
表示阿伏加德罗常数的值,下列说法正确的是( )
A. 在标准情况下,22.4L![]() 含有的分子数为
含有的分子数为![]()
B. 1L 0.1 molL—1的MgCl2溶液中含Mg2+的数目为0.1NA
C. 17.6g丙烷中所含的共价键数目为4NA
D. 20 ml 2mol L—1 H2O2完全分解,转移的电子数为0.08NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com