
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:

已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中![]() 等于_________________
等于_________________
【答案】六![]() H2SiO3CWO42-+2H+=H2WO4↓取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题。5×10-5
H2SiO3CWO42-+2H+=H2WO4↓取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题。5×10-5
【解析】白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,白钨矿与碳酸钠在1000℃温度下反应,二氧化硅与碳酸钠会反应生成硅酸钠,氧化铁不反应,得到的混合物用水浸取,过滤后的滤液经过系列操作得到WO3,说明碳酸钠与CaWO4反应生成Na2WO4,则滤渣A为氧化铁等,滤液中含有Na2SiO3、Na2WO4,再调节pH在5~8之间,使硅酸根转化为H2SiO3沉淀过滤除去,母液中含有Na2WO4,再加入盐酸得到沉淀C为H2WO4,灼烧产生三氧化钨和水,再还原得到钨;
(1)由74-2-8-8-18-32=6,可钨处于第六周期;
(2)CaWO4与纯碱反应生成Na2WO4、CaO与二氧化碳,反应方程式为:CaWO4+Na2CO3![]() Na2WO4+CaO+CO2↑;
Na2WO4+CaO+CO2↑;
(3)滤渣B的主要成分为H2SiO3,调节溶液pH使硅酸根转化为H2SiO3沉淀过滤除去,应加入盐酸;
(4)母液中Na2WO4与盐酸得到H2WO4沉淀与氯化钠,反应离子方程式为:WO42-+2H+=H2WO4↓;检验沉淀C是否洗涤干净的操作是:取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净;
(5)如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题;
(6)当溶液中WO42-恰好沉淀完全,其离子浓度等于10-5mol/L,根据Ksp(CaWO4)=c(Ca2+)×c(WO4-)=1×10-10,则溶液中c(Ca2+)=1×10-5mol/L,再根据Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=4×10-7,可知c(OH-)=0.2mol/L,则溶液中![]() =5×10-5。
=5×10-5。


科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
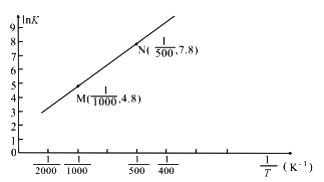
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届浙江省名校协作体高三下学期】
恒温恒容装置中发生如下反应:A(g)+2B(g)![]() 2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
2C(g) ΔH = -a kJ·mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如下图所示。下列说法正确是
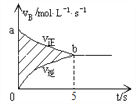
A. 反应放出的热量一定小于a kJ
B. 5s后,反应停止,各物质浓度保持不变
C. 5s末,ν(A)︰ν(B)=1︰2
D. 阴影部分面积可以表示A的物质的量浓度减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98KJ。在含有少量I![]() 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
① H2O2+ I![]()
![]() H2O+IO
H2O+IO![]() (慢)②H2O2+ IO
(慢)②H2O2+ IO![]()
![]() H2O+O2+ I
H2O+O2+ I![]() (快)
(快)
下列有关该反应的说法正确的是
A. 反应速率与I![]() 浓度有关 B. IO
浓度有关 B. IO![]() 也是该反应的催化剂
也是该反应的催化剂
C. 该化学反应速率由反应②决定 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com