
����Ŀ����ҵ����ȡ������CuCl22H2O����Ҫ�����ǣ��ٽ�������ͭ��������Fe��������������ʣ��ܽ���ϡ�����У����ˣ��ڶԢ�������Һ�����в�����в����� 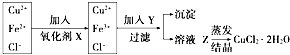 ��֪Fe3+��Fe2+��Cu2+��ʼ����ʱ��pH�ֱ�Ϊ1.9��7.0��4.7��������ȫʱpH�ֱ�Ϊ3.2��9.0��6.7����ش��������⣺
��֪Fe3+��Fe2+��Cu2+��ʼ����ʱ��pH�ֱ�Ϊ1.9��7.0��4.7��������ȫʱpH�ֱ�Ϊ3.2��9.0��6.7����ش��������⣺
��1����֪H2O2��KMnO4��NaClO��K2Cr2O7������ǿ�����ԣ��������ʺϵ�X�� �� �䷴Ӧ�����ӷ���ʽ�� ��
��2��Y���ʵ������ǵ�����Һ���ԣ�ʹpHΪ3��4�����������Լ�����ѡ�õ���������ţ���
A.��ˮ
B.Cu��OH��2
C.Cu2��OH��2 CO3
D.Na2CO3
��3����Y��CuO�����ȥFe3+�����ӷ���ʽ��
��4����ҺZ�������ᾧʱӦע�� ��
���𰸡�
��1��H2O2��2H++H2O2+2Fe2+=2Fe3++2H2O
��2��BC
��3��CuO+2H+=Cu2++H2O
��4��ͨ��HCl���壨��������ᣩ,�����Ͻ����Ҳ�������
���������⣺��ҵ����ȡ������CuCl22H2O����Ҫ���̣���������ͭ��������Fe���ܽ���ϡ�����У�����ͭ�����ᷴӦ�����Ȼ�ͭ���������ᷴӦ�����Ȼ����������ˣ���Һ�к����������ӡ�ͭ���ӡ������ӣ��������������������������������ӣ�Ȼ�����Y������Һ��pH����������ת������������������ȥ���õ�����ҺZΪ�Ȼ�ͭ��Һ��Ȼ���ڳ���ͨ��HCl���岢���Ͻ���������������Һ�һ���Ȼ�ͭ���壮��1����������ͼ��֪ʵ��Ŀ�����Ʊ��Ȼ�ͭ���壬��Ҫ��ȥ�������ӣ������XΪ�������������������µ����ʣ�X�ǹ���������Һ��������Һ��Ҳ����������������Ϊ�������Ҳ������µ����ʣ���Ӧ�����ӷ���ʽΪ��2H++H2O2+2Fe2+=2Fe3++2H2O��
���Դ��ǣ�H2O2��2H++H2O2+2Fe2+=2Fe3++2H2O����2��Y����Ӧ������Һ�����ԣ�������ҺPHʱ������ȫ��������ͭ���Ӳ��ܳ����Ҳ��������µ��������ӣ�ʵ����Ҫ������ᷴӦ�Ĺ�������CuO��Cu��OH��2����֪Cu2+��Fe2+��pHΪ4��5ʱ��ˮ�⣬��Fe3+������ȫˮ���������������ҺPHֵ4����5��ʹ��������ȫ������
���Դ��ǣ�BC����3��Y��CuO�������ᷴӦ����ͭ���Ӻ�ˮ��������ҺpH�������������ӵ�ˮ�⣬����ʽΪCuO+2H+=Cu2++H2O�����Դ��ǣ�CuO+2H+=Cu2++H2O����4���Ȼ�ͭˮ��Һ����Ũ����ͭ����ˮ�⣬CuCl2+H2OCu��OH��2+2HCl�����ɵ��Ȼ���ӷ������ȴٽ�ˮ��������У��õ�������ͭ������ʵ����Ҫ���Ȼ�������������������ˮ�ⷴӦ���У������õ��Ȼ�ͭ���壻
���Դ��ǣ�ͨ��HCl���壨��������ᣩ�������Ͻ����Ҳ������ɣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���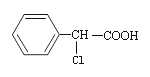 �ж���ͬ���칹�壬����������������ԭ��ֱ�����ڱ����ϵ�ͬ���칹���ж����֣������������칹���� ��
�ж���ͬ���칹�壬����������������ԭ��ֱ�����ڱ����ϵ�ͬ���칹���ж����֣������������칹���� ��
A. 6�� B. 9�� C. 15�� D. 19��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]��Ȳ���ڴ��������¿ɷ���ż����Ӧ����ΪGlaser��Ӧ��
2R��C��C��H![]() R��C��C��C��C��R+H2
R��C��C��C��C��R+H2
�÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�Ʊ�������E��һ�ֺϳ�·�ߣ�

�ش��������⣺
��1��B�Ľṹ��ʽΪ______��D �Ļ�ѧ����Ϊ______��
��2���������ķ�Ӧ���ͷֱ�Ϊ______��______��
��3��E�Ľṹ��ʽΪ______����1 mol E�ϳ�1,4���������飬��������Ҫ��������_______mol��
��4�������![]() ��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
��5�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3:1��д������3�ֵĽṹ��ʽ_______________________________��
��6��д����2�����Ҵ�Ϊԭ�ϣ��������Լ���ѡ���Ʊ�������D�ĺϳ�·��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.2000molL��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£� ��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�۵���Һ������0����0���̶������£������¶�����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ����д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ������ƫ����ƫС������Ӱ�족�� ��
��2���жϵζ��յ�������ǣ� ��
��3����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪmL�� ![]()
��4�������������ݣ���������������Һ��Ũ�ȣ�mol/L��
�ζ����� | ���������mL�� | ���ռ������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������Ҵ���������ȷ����
A. �״Ĵ�ζԴ���Ҵ� B. ����Ҫ�ɷ�Ϊ����
C. ���߾�Ϊ���� D. ������һ�������¿ɷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�С��������±���ʾ��ԭ���ʵ��:
ʵ���� | �� | �� |
ʵ��װ�� |
|
|
ʵ������ | ����װ��5 ���Ӻ�����������ָ������ƫת������ͭƬ��������������� | �����Ƭ��������������ݣ�����װ��5 ���Ӻ�����������ָ������ƫת���Ҳ���Ƭ�������������� |
���й��ڸ�ʵ��������У���ȷ����
A. ��װ�õ������У������Ӿ����Ҳ��ƶ�
B. ʵ�����У�����ͭ����ʴ
C. ʵ�����У����缫�ĵ缫��ӦʽΪ2H++ 2e-=H2��
D. ʵ���� ��ʵ�����У�����O2 �õ��ӵķ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1molL��1 �� ������Һ����μ��백ˮ������ʱ����Һ�ĵ���������������Ӧ�ı仯�������ǿ��I����백ˮ�������V���仯�����߹�ϵ��ͼ�еģ�������
A.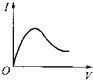
B.
C.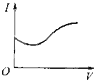
D.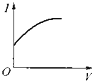
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܡ����ܷ����õ��㷺Ӧ�ã��ڷ���ϵͳ�а�װ����װ�������ڳ����ȶ����磬�乹��ļ�ͼ����:

��1������˵���У���ȷ����______( ����ĸ���)��
a.̫���ܡ����ܶ��������Դ
b.̫���ܵ����ʵ����̫���ܵ����ܵ�ת��
c.����ϵͳ�ܹ����ƴ���ϵͳ�dz�绹�Ƿŵ�
d.������������ʱ������ϵͳʵ���ɻ�ѧ�ܵ����ܵ�ת��
��2��ȫ��Һ������Ǿ��з�չǰ���ġ���������ϵͳ�����ء���֪�ŵ�ʱV2+����������Ӧ����ŵ�ʱ�缫A �ĵ缫��ӦʽΪ___________�����ʱ�缫B ��______����
��3��������ˮ�����ˮ����Ⱦ���Ժ�����ˮ(��VO2+�⣬������Al3+��Fe3+��)�����ۺϴ�����ʵ�ַ���Դ�Ļ������ã���������:

��֪��ҺpH ��Χ��ͬʱ�����Ĵ�����ʽ���±���ʾ:
���Ļ��ϼ� | pH<2 | pH>11 |
+4�� | VO2+��VO(OH)+ | VO(OH)3- |
+5�� | VO2+ | VO43- |
������NaOH ������ҺpH��13ʱ������1������������ɻҰ�ɫת��Ϊ���ɫ���û�ѧ�����ʾ����NaOH �����ɳ���1�ķ�Ӧ����Ϊ_______��_______��������Һ1�У���Ԫ�صĴ�����ʽΪ__________��
������Ե���Һ1( V�Ļ��ϼ�Ϊ+4 )�м���H2O2��������________(�����ӷ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա���Ƴ�һ���������ɺ����� NaCO2��ء��õ�طŵ�ʱ��������CO2�����ʱ��������CO2������CO2ʱ���乤��ԭ������ͼ��ʾ�������ȫ��CO2�У���![]() ת��ΪNa2CO3��������ڶ��̼����(MWCNT)�缫���档����˵����ȷ����
ת��ΪNa2CO3��������ڶ��̼����(MWCNT)�缫���档����˵����ȷ����

A. ��������CO2ʱ���Ʋ�Ϊ����
B. ��������CO2ʱ��������ӦΪ4Na����3CO2��4e��===2Na2CO3��C
C. ��������CO2ʱ��Na������̼���ܵ缫�ƶ�
D. ��״���£�ÿ�������� 22.4 L CO2��ת�Ƶ��ӵ����ʵ���Ϊ0.75 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com