
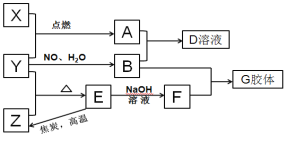
【题目】2019年4月,陨石坠落哥斯达黎加,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:
(1)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析标明电子转移数目_____.
(2)写出E与 NaOH溶液反应的离子方程式 ______
(3)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法:______
(4)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____;净化G胶体可采用图___(填序号)的方法,此种方法叫_____。

【答案】![]() SiO2 + 2OH- = SiO32-+ H2O 取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在 电泳 ② 渗析
SiO2 + 2OH- = SiO32-+ H2O 取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在 电泳 ② 渗析
【解析】
由于E为陨石的主要成分,也是石英砂的主要成分,因此E为SiO2;A为黑色磁性氧化物,因此A为Fe3O4,由于X、Y、Z为单质,所以X为Fe、Y为氧气、Z为Si。由此可推断出B为硝酸、D为硝酸铁溶液、F为硅酸钠溶液、G为硅酸凝胶,由此解题。
(1) SiO2与焦炭在高温下反应制取Si的化学方程式为:SiO2+2C![]() Si+2CO↑,用单线桥表示其电子转移数目为
Si+2CO↑,用单线桥表示其电子转移数目为![]() ;
;
(2) SiO2是酸性氧化物,与 NaOH溶液反应生成盐和水,其离子方程式可表示为:SiO2 + 2OH- = SiO32-+ H2O;
(3) Fe3O4与足量的稀硝酸反应生成硝酸铁溶液,因此溶液中的阳离子为Fe3+,其检验的方法为:取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在;
(4)在外加直流电作用下,胶粒做定向移动的现象为电泳现象;净化胶体主要是洗去胶体中的离子,所以应采用渗析的方法,选择的是图②中的装置。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应I的化学方程式是________。
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层,含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a 两层溶液的密度存在差异
b 加I2前,H2SO4溶液和HI溶液不互溶
c I2在HI溶液中比在H2SO4溶液中易溶
② 辨别两层溶液的方法是____________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因______。
(3)反应II : 2H2SO4(l)=2SO2(g) +O2(g) +2H2O(g) △H=+550 kJ mol-1
它由两步反应组成:
i.H2SO4(l)=SO3(g) +H2O(g) △H =+177 kJ mol-1
ii.SO3(g)分解。
L(L1, L2)和X可分别代表压强或温度,下图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。

①写出反应iiSO3(g)分解的热化学方程式:________。
②X代表的物理量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:

(1)甲同学认为,不通入空气,将K与______(填“a”或“b”)连接,即可实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。
(2)乙同学认为在通入空气的同时,将开关K与____(填“a”或“b”)连接,也可以实现。电池总反应的化学方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。

(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如下图所示。

(1)途径Ⅰ碱浸时发生反应的化学方程式为_________________________。
(2)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为___________________________。
(3)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图。


①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是_____________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g·mol-1)的物质的量浓度为_____(计算结果保留3位有效数字)。
(5)二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n,则电池放电时正极的电极反应是_________。
Lix(MoS2)n,则电池放电时正极的电极反应是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中错误的是
A. 三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
B. 立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有3种
)经硝化可得到六硝基立方烷,其可能的结构有3种
C. β-月桂烯(![]() )与溴发生1:1加成反应,产物(只考虑位置异构)有3种
)与溴发生1:1加成反应,产物(只考虑位置异构)有3种
D. 酯类化合物C4H8O2在酸性条件下水解得到的醇可能有4种不同结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为______mol·L-1。
84消毒液
有效成分:NaClO
规格:1000 mL
质量分数:25%
密度:1.19 g·cm-3
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该物质的量浓度的消毒液。下列说法正确的是_____(填字母)。

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于配制溶液
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀盐酸混合会产生一种黄绿色的气体,写出反应的离子方程式:_____
(4)钛铁矿(主要成分为FeTiO3,Ti为+4价)加盐酸“酸浸”后,钛主要以TiOCl42-形式存在,写出反应的离子方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
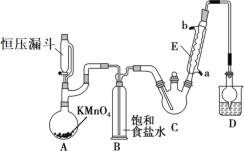
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com