
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
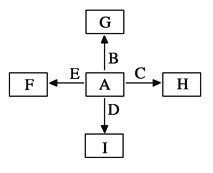
已知:①G为红棕色固体,能发生反应C+G![]() B+H,该反应会放出
B+H,该反应会放出
大量的热②I是一种常见的温室气体,它和E可以发生反应:
2E+I![]() 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为_____________________;
(2)化合物I的电子式为___________,它的空间构型是________________;
(3)8.0g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量____________g;
(4)C与过量NaOH溶液反应后溶液与过量化合物I反应的离子方程式为_____________;
(5)E在I中燃烧观察到的现象是_________________。
【答案】(1)2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
(2)![]() 直线形
直线形
(3)3.2 (4)AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-
剧烈燃烧,发出耀眼的白光,有白色固体生成(注:白色固体不写不给分)
【解析】
试题分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知G为红棕色固体,能发生反应C+G![]() B+H,该反应会放出大量的热,所以G是氧化铁,C是Al,B是Fe,H水解氧化铝,则A是氧气;I是一种常见的温室气体,则I是二氧化碳,因此D是碳,它和E可以发生反应:2E+I
B+H,该反应会放出大量的热,所以G是氧化铁,C是Al,B是Fe,H水解氧化铝,则A是氧气;I是一种常见的温室气体,则I是二氧化碳,因此D是碳,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。所以E是镁,F是氧化镁。
2F+D,F中E元素的质量分数为60%。所以E是镁,F是氧化镁。
(1)根据以上分析可知①中反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)化合物二氧化碳的电子式为![]() ,它的空间构型是直线形;
,它的空间构型是直线形;
(3)8.0g 氧化铁是0.05mol,溶于盐酸得到0.1mol铁离子,与铜粉完全反应,根据方程式2Fe3++Cu=2Fe2++Cu2+可知至少所需铜粉的质量为0.05mol×64g/mol=3.2g;
(4)C与过量NaOH溶液反应后溶液是偏铝酸钠,与过量化合物二氧化碳反应的离子方程式为AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)镁在二氧化碳中燃烧生成氧化镁和碳,则E在I中燃烧观察到的现象是剧烈燃烧,发出耀眼的白光,有白色固体生成。


科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:

部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4![]() 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0. 5molMn2+时,用去1molL-1的NaClO3溶液200ml,该反应离子方程式为
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_____________。
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 。如果维持电流强度为5A,电池工作五分钟,理论消耗锌 g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 。
。向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2 。
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为 时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全)。继续加碱调节pH为 时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸正丁酯是重要的有机原料,可通过酯化反应制得。已知A的核磁共振氢谱吸收峰的高度比为3:2:2:1,丙烯在通常条件下稳定,但遇强氧化剂时容易被氧化生成CO2。
Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2![]() A(液态)
A(液态) 正丁醇;
正丁醇;
(1)已知反应1的原子理论利用率为100%,请写出A的结构简式 。
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号,试剂可以重复使用)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
某研究性学习小组利用如图装置进一步合成甲酸正丁酯。

(3)大试管中溶液的作用除了溶解正丁醇外,还有 。
(4)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是 。
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲 酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。
甲酸 | 正丁醇 | 甲酸正丁酯 | |
熔点/℃ | 8.4 | -88.9 | -91 |
沸点/℃ | 100.8 | 117.7 | 107 |
溶解性 | 三者能相互溶解。 | ||
上述流程图中,操作1是 ,试剂b是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向混合溶液甲中缓慢滴加溶液乙,反应生成沉淀的质量如图所示,其中可能符合图象的一组是
甲 | 乙 |
| |
A. | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
B. | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
C. | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
D. | NaAlO2、NH3·H2O、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Fe和Ag2SO4溶液
C.Ag和AgNO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.______________________ _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol Na2CO3·10H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1 mol Na2 CO3(s)溶于水会使溶液温度升高,热效应为△H2;Na2CO3·10H2O受热分解的化学方程式为Na2CO3·10H2O (s) ![]() Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
A.△H2 <△H3 B.△H1>△H3 C.△Hl+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅和石英玻璃的有关说法不正确的是
A. 二氧化硅晶体熔点高
B. 石英玻璃中含有硅酸盐、二氧化硅,耐任何酸碱腐蚀
C. 石英玻璃制成的光导纤维是一种新型无机非金属材料
D. 石英玻璃有较高的熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com