
1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
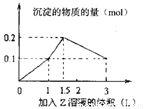
A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸
C
【解析】
试题分析:A.若向混合溶液中滴加NaOH溶液会发生反应:Fe3++3OH-=Fe(OH)3↓;Al3++3OH-=Al(OH)3↓立即产生沉淀.但当沉淀达到最大值后,再继续滴加会发生反应:Al(OH)3 +OH-=AlO2-+2H2O 。由Al3+形成沉淀和沉淀溶解的OH-的消耗量可以看出物质的量的比为:3:1,这与图像中的比例不符合。错误。B.会发生反应Mg2++2OH-=Mg(OH)3↓;Al3++3OH-=Al(OH)3↓立即产生沉淀.但当沉淀达到最大值后,再继续滴加会发生反应:Al(OH)3 +OH-=AlO2-+2H2O 。由Al3+形成沉淀和沉淀溶解的OH-的消耗量可以看出物质的量的比为:3:1,这与图像中的比例不符合。错误。C.若向混合溶液中滴加H2SO4溶液会发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O.当 该反应完全后,发生反应:2NaAlO2+H2SO4+2H2O =Na2SO4+2Al(OH)3↓.当沉淀达到最大值后继续滴加硫酸,发生反应2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.。直至氢氧化铝完全溶解。物质的量的比符合要求。正确。D.若向偏铝酸钠和氯化钡的混合溶液中滴入硫酸时发生反应:SO42-+Ba2+=BaSO4↓。AlO2-+H++H2O= Al(OH)3↓。当第一个反应完成一半时,第二个反应进行完全。此后随着硫酸的加入。第一个反应继续进行,同时还发生反应:Al(OH)3+3H+=Al3++3H2O。沉淀的质量增加但是幅度原来小。当氯化钡反应完全,沉淀达到最大值,此后无论如何滴加,沉淀的质量也不再发生改变。错误。
考点:考查图像法在物质成分飞确定中的应用的知识。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| m |
| (m+1000) |
| m |
| (m+1000) |
| 18V |
| 11.2 |
| 18V |
| 11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,等浓度的亚硫酸溶液导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol/L的H2SO3溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有Na2SO3和N2H4(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是 。
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是 (填最简整数比)。
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是 。
(4)已知Na2SO3在高温下发生分解,得到两种产物。某同学称取25.2g纯净的Na2SO3·7H2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①Na2SO3高温分解的化学方程式是 。
②测得溶液的pH大于0.025mol/LNa2SO3溶液的pH,试解释原因(结合离子方程式说明) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com