
【题目】在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到60s时体系达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A. 平衡时,N2O4的转化率为60%
B. 平衡时,体系内NO2为0.04mol·L-1
C. 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数增大
D. 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.所有卤代烃都是通过取代反应制得
C.卤代烃不属于烃类
D.卤代烃都可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如右图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )

A. 最外层电子数:甲>乙>丙>丁>戊
B. 简单离子的离子半径:戊>丁
C. 含有丁元素的酸有多种
D. 乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) A为 元素,B为 元素,C为 元素,D为 元素,E为 元素 (填元素名称)。
(2) C元素在周期表中属 周期 族元素,原子结构简图为 。
(3) 用电子式表示D与E形成化合物的过程____________________________________,D与B形成的化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,下列酸的电离常数:醋酸(CH3COOH):1.75×10-5、氢氰酸(HCN): 4.93×10-10、氢氟酸(HF):7.2×10-4、甲酸(HCOOH): 1.77×10-4,物质的量浓度均为0.1molL-1的上述溶液,酸性最强的是( )
A. 醋酸B. 氢氰酸C. 氢氟酸D. 甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,玻璃管B中装有CuO(用石棉绒作载体)。请回答下列问题:

(1)向试管A中鼓入空气的目的是_____________________________。
(2)玻璃管中可观察到的现象是_______________________________;相关化学方程式是_____________________________________。
(3)试管C中放的是蒸馏水,在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铁矿(主要成分为FeS2)为原料进行如下实验探究。为测定黄铁矿中硫元素的质量分数,将m1g该黄铁矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品。
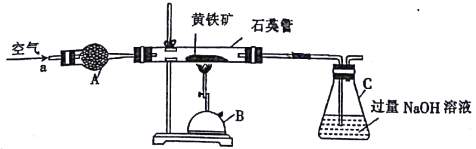
(1)仪器B的名称是________________。
(2)仪器A的作用是______________,锥形瓶C中NaOH溶液的作用是______________。
(3)反应结束后将锥形瓶C中的溶液进行如下处理:

①操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法为______________________。
②上述流程中生成固体反应的离子方程式为__________________。
③经过分析,向m2g固体中加入过量稀盐酸时,无明显现象,则该黄铁矿中硫元素的质量分数为____(用含m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com