
镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把 (填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是 ,属于难溶物的电离方程式 。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定 b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价
(1)a(1分)
(2)Cl->O2->Mg2+>Al3+>H+
(3)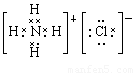 (1分) H++AlO2–+H2O
(1分) H++AlO2–+H2O Al(OH)3
Al(OH)3 Al3++3OH–(2分)
Al3++3OH–(2分)
(4)c(2分)
【解析】
试题分析:(1)为使Mg2+、Al3+同时生成沉淀,应该把AlCl3和MgCl2的混合溶液滴入到过量的氨水中,因此正确的答案选a。
(2)根据微粒电子层越多,半径越大.。在核外电子排布相同的条件下,核电荷数越多,微粒半径越小,据此可知离子的半径大小顺序是Cl->O2->Mg2+>Al3+>H+。
(3)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵,氯化铵是离子化合物,电子式为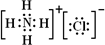 。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O
。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O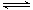 Al(OH)3
Al(OH)3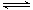 Al3++3OH-。
Al3++3OH-。
(4)a.非金属性越强,氢化物的稳定性越强,所以根据H2O比NH3稳定,可以证明氧元素的非金属性比氮元素强,故a错误;b.共用电子对偏向:H-O>H-N,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故b错误;c.沸点:H2O>NH3是物理性质的表现,但是氧元素的非金属性比氮元素强是化学性质的表现,故C正确;d.NO中氮是+2价,氧是-2价,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故d错误,答案选c。
考点:考查氢氧化镁、氢氧化铝的生成;氢氧化铝的性质;电子式以及非金属性强弱比较等


科目:高中化学 来源: 题型:
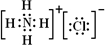
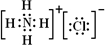
查看答案和解析>>
科目:高中化学 来源:上海市杨浦区2013年高考一模化学试题 题型:022
镁铝尖晶石(MgAl2O4)常做耐火材料.共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧.
完成下列填空:
1.为使Mg2+、Al3+同时生成沉淀,应该把________(填“a”或“b”)滴入另一溶液中.
2.将上述制备反应中部分元素的简单离子:Al3+、Cl-、Mg2+、H+、O2-按半径由大到小的顺序排列________(用离子符号表示).
3.AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是________,属于难溶物的电离方程式________.
4.不能说明氧元素的非金属性比氮元素强的事实是________.
a.H2O比NH3稳定
b.共用电子对偏向:H-O>H-N
c.沸点:H2O>NH3
d.NO中氮是+2价,氧是-2价
查看答案和解析>>
科目:高中化学 来源: 题型:
A MgAl2O3? B.MgAl2O4? C.Mg2Al2O5? D.Mg3Al2O6
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com