镁铝尖晶石(MgAl2O4)常做耐火材料.共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧.
完成下列填空:
为使Mg2+、Al3+同时生成沉淀,应该把______(填“a”或“b”)滴入另一溶液中.
(1)将上述制备反应中部分元素的简单离子:Al3+、Cl-、Mg2+、H+、O2-按半径由大到小的顺序排列______(用离子符号表示).
(2)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是______,属于难溶物的电离方程式______.
(3)不能说明氧元素的非金属性比氮元素强的事实是______.
a.H2O比NH3稳定 b.共用电子对偏向:H-O>H-N
c.沸点:H2O>NH3 d.NO中氮是+2价,氧是-2价.
解:为使Mg
2+、Al
3+同时生成沉淀,应该把AlCl
3和MgCl
2的混合溶液滴入到氨水中,故选:a;
(1)根据微粒电子层越多,半径越大,电子层相同,核电荷数越多,半径越小的规律,离子的半径大小顺序是:Cl
->O
2->Mg
2+>Al
3+>H
+,
故答案为:Cl
->O
2->Mg
2+>Al
3+>H
+;
(2)AlCl
3与氨水反应生成氢氧化铝沉淀和氯化铵,氯化铵是离子化合物,电子式为:

,氢氧化铝是两性氢氧化物,
电离方程式为:H
++AlO
2-+H
2O?Al(OH)
3?Al
3++3OH
-,
故答案为:
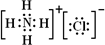
;H
++AlO
2-+H
2O?Al(OH)
3?Al
3++3OH
-;
(3)a.H
2O比NH
3稳定,可以证明氧元素的非金属性比氮元素强,故a错误;
b.共用电子对偏向:H-O>H-N,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故b错误;
c.沸点:H
2O>NH
3是物理性质的表现,但是氧元素的非金属性比氮元素强是化学性质的表现,故C正确;
d.NO中氮是+2价,氧是-2价,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故d错误;
故选c.
分析:镁离子、铝离子可以同时和氢氧根离子反应生成沉淀;(1)微粒电子层越多,半径越大,电子层相同,核电荷数越多,半径越小;
(2)AlCl
3与氨水反应生成氢氧化铝沉淀和氯化铵;(3)证明元素的非金属性强弱的事实有:氢化物的稳定性,原子的得电子能力,单质和氢气化合的难易程度等.
点评:本题涉及元素周期表和元素周期律的有关知识,要求学生学会微粒半径大小比较的方法、电子式的书写等知识,难度不大.

 ,氢氧化铝是两性氢氧化物,
,氢氧化铝是两性氢氧化物,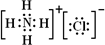 ;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;

 H2+CO,其中,水是________剂.硫在氧气中燃烧的化学方程式是________,其中,硫是________剂.
H2+CO,其中,水是________剂.硫在氧气中燃烧的化学方程式是________,其中,硫是________剂. Sb4O6+6FeS ②Sb4O6+6C
Sb4O6+6FeS ②Sb4O6+6C 4Sb+6CO↑
4Sb+6CO↑