
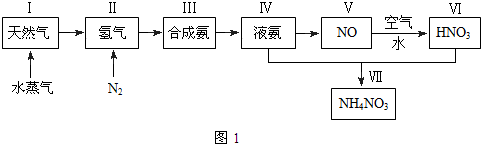
分析 工业上合成氨和硝酸铵的联合生产:天然气和水蒸气发生反应CH4+H2O═CO+3H2,氮气和氢气发生反应N2+3H2 2NH3;氨气易液化,通过液化分离出氨气,氨气催化氧化,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H20,一氧化氮和氧气和水反应生成硝酸,4NO+3O2+2H2O=4HNO3,氨气和硝酸反应生成硝酸铵.
2NH3;氨气易液化,通过液化分离出氨气,氨气催化氧化,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H20,一氧化氮和氧气和水反应生成硝酸,4NO+3O2+2H2O=4HNO3,氨气和硝酸反应生成硝酸铵.
(1)硝酸铵是强酸弱碱盐,铵根离子水解使硝酸铵溶液显酸性;
(2)Ⅴ→Ⅵ过程在吸收塔中进行,2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3,为使NO充分氧化而生成硝酸,应通入过量空气;
(3)吸收液为氨水,产物为NH4HS,吸收液再生,即反应过程中生成一水合氨,依据原子守恒和电子守恒书写化学方程式;
(4)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
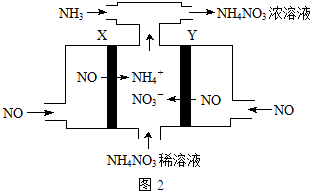
(5)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+;
(6)根据氮原子守恒可知,NH3~NO~HNO3,假设氨气为1mol,根据原子守恒计算制备的硝酸,每一步损失率、利用率都以氨气计算.
解答 解:(1)NH4NO3溶于水,溶液显酸性,是因为铵根离子水解使硝酸铵溶液显酸性,水解离子反应为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)Ⅴ→Ⅵ过程在吸收塔中进行,2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3,为使NO充分氧化而生成硝酸,应通入过量空气,增大NO的转化率,
故答案为:增大NO的转化率;
(3)H2S杂质常用氨水吸收,产物为NH4HS,吸收液为氨水,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,即反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓,
故答案为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓;
(4)①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ•mol-1
依据盖斯定律①×$\frac{1}{2}$+②-③×$\frac{1}{2}$得到热化学方程式为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=(-566.0kJ•mol-1)×$\frac{1}{2}$+(+206.2kJ•mol-1)-(-571.6kJ•mol-1
)×$\frac{1}{2}$=+209 kJ•mol-1;
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+209 kJ•mol-1;
(5)电解NO制备NH4NO3,阳极发生氧化反应,NO被氧化生成NO3-,由装置图可知,电极Y是阳极,反应为NO-3e-+2H2O=NO3-+4H+,则X为阴极,阴极反应为:NO+5e-+6H+=NH4++H2O
故答案为:阴; NO-3e-+2H2O=NO3-+4H+;
(6)由NH3制NO的产率是90%、NO制HNO3的产率是85%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×90%×85%=0.765mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.765mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为$\frac{1}{1+0.765}$×100%≈57%,
故答案为:57.
点评 本题考查工业上合成氨和硝酸铵,涉及反应热计算、多步反应的有关计算、电解等知识,侧重考查学生分析思维能力,注意利用守恒思想计算,也可以利用关系式计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| C. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮元素及其化合物在生产、生活中有着广泛的应用.
氮元素及其化合物在生产、生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com