
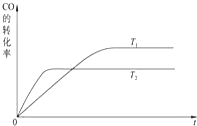
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.分析 (1)①图象中先拐先平温度高,温度越高CO转化率越小,说明升温平衡逆向进行,正反应为放热反应;
②a.反应为放热反应,反应物能量高于生成物;
b.反应是可逆反应不能进行彻底;
c.反应焓变和物质能量有关,与变化过程无关;
d.如将一定量CO(g) 和H2(g)置于某密闭容器中充分反应后放热aKJ,是反应焓变的数值,是1molCO完全反应放出的热量;
(2)①化学平衡三段式列式计算,压强关系是气体物质的量的关系;
②平衡标志是正逆反应速率相同,各组分含量保持不变,据此分析选项;
(3)结合热化学方程式和盖斯定律计算得到所需热化学方程式,
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-bkJ•mol-1
③H2O(g)═H2O(l)△H═-ckJ•mol-1
依据盖斯定律计算,$\frac{①+4×③-②}{2}$得到热化学方程式;
(4)甲醇燃料电池甲醇在负极失电子,碱溶液中生成碳酸盐,依据溶液中氢氧根离子配平电荷守恒.
解答 解:(1)①CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol.图象分析可知先拐先平温度高,温度越高CO转化率越小,说明升温平衡逆向进行,正反应为放热反应,△H<0,则a>0,
故答案为:>;
②CO(g)+2H2(g)?CH3OH(g)△H═-86.6KJ/mol,反应是气体体积减小的放热反应;
a.反应为放热反应,1mol CO(g)和2mol H2(g)所具有的能量大于1mol CH3OH(g)所具有的能量,故a错误;
b.将1mol CO(g)和2mol H2(g)置于一密闭容器中充分反应,反应为可逆反应不能进行彻底,反应后放出的热量小于a KJ,故b错误;
c. 为放热反应,升高温度,平衡向逆反应移动,上述热化学方程式中的a值是焓变数值,确定的化学反应,焓变不随温度变化,只与起始和终了物质能量差有关,故c错误;
d.如将一定量CO(g) 和H2(g)置于某密闭容器中充分反应后放热aKJ,是反应焓变的数值,则此过程中有1molCO(g)被还原.故d正确;
故答案为:d;
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H═-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入Imol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的$\frac{3}{5}$,依据化学平衡三段式列式,设消耗的一氧化碳物质的量为x;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=3×$\frac{3}{5}$
x=0.6,
一氧化碳转化率=60%,
故答案为:60%;
②CO(g)+2H2(g)?CH3OH(g)△H═-86.6KJ/mol,反应是气体体积减小的放热反应;
A.反应速率之比等于化学方程式系数之比,是正反应之比,v(H2)正═2v(CH3OH)逆,才能说明反应达到平衡状态,故A错误;
B.CO的消耗速率等于CH3OH的生成速率,说明反应正向进行,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量改变,容器内的压强保持不变,气体物质的量不变,说明反应达到平衡状态,故C正确;
D.气体质量不变,体积固定,混合气体的密度保持不变,不能说明反应达到平衡状态,故D错误;
E.混合气体都是无色气体,颜色保持不变不能说明反应达到平衡状态,故E错误;
F.气体质量不变,物质的量变化,混合气体的平均相对分子质量不随时间而变化,说明反应达到平衡状态,故F正确;
故答案为:CF;
(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-bkJ•mol-1
③H2O(g)═H2O(l)△H═-ckJ•mol-1
依据盖斯定律计算,$\frac{①+4×③-②}{2}$得到热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H═$\frac{b-a-4c}{2}$KJ/mol;
故答案为:$\frac{b-a-4c}{2}$;
(4)燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,负极电极反应:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查了化学平衡影响因素、平衡转化率计算、热化学方程式书写、原电池电极反应和盖斯定律计算应用,电解池中电子守恒的计算分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
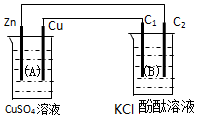 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
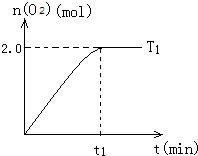 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com