
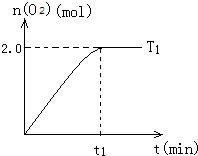
 һ���¶��£���2L�ܱ������м�������Cu2O��ͨ��10.0molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ/mol��T1�¶��²�ͬʱ�β���O2������������
һ���¶��£���2L�ܱ������м�������Cu2O��ͨ��10.0molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ/mol��T1�¶��²�ͬʱ�β���O2������������| ʱ��/min | 20 | 40 | 60 | 80 |
| n��O2��/mol | 1.0 | 1.6 | 2.0 | 2.0 |
���� ��1�����ݻ�ѧ��Ӧ����֮�ȵ��ڼ�����֮�ȼ��㷴Ӧ���ʣ�
��2����ƽ��ʱ��K=$\frac{����������ƽ��Ũ��ϵ������֮��}{������Ӧ��ƽ��Ũ��ϵ������֮��}$��
��3����������ʽ����ƽ�ⳣ���������¶Ⱥ�ƽ�ⳣ��֮��Ĺ�ϵ���ش�
��4���������ȵķ�Ӧ�������¶ȣ�ƽ�������ƶ������Ƿ�Ӧ���ʻ������
��5������ȼ�����Ե���У�����������ʧ�������������ӣ�
��� �⣺��1���ɱ������ݿ�֪ǰ20minʱv��O2��=$\frac{0.1mol}{2L��20min}$=2.5��10-2 mol��L-1��min -1����v��H2O��=2v��O2��=5.0��10-2 mol��L-1��min -1���ʴ�Ϊ��5.0��10-2 mol��L-1��min -1��
��2���÷�Ӧ��ƽ�ⳣ������ʽK=$\frac{{c}^{2}��{H}_{2}����c��{O}_{2}��}{{c}^{2}��{H}_{2}O��}$���ʴ�Ϊ��K=$\frac{{c}^{2}��{H}_{2}����c��{O}_{2}��}{{c}^{2}��{H}_{2}O��}$��
��3��2H2O��g��?2H2��g��+O2��g��
��ʼŨ�ȣ�5 0 0
�仯Ũ�ȣ�2 2 1
ƽ��Ũ�ȣ�3 2 1
������µ�ƽ�ⳣ��K=$\frac{1��{2}^{2}}{{3}^{2}}$=$\frac{4}{9}$����T2�¶�ʱ��K=0.4����Ӧ�����ȵģ�����T1��T2���ʴ�Ϊ��T1��T2��
��4��2H2O��g��?2H2��g��+O2��g�������ȵķ�Ӧ�������¶ȣ�ƽ�������ƶ������������ʵ����ή�ͣ����Ƿ�Ӧ���ʻ������ͼ��Ϊ��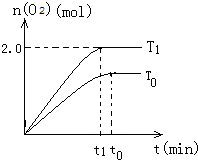 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5������ȼ�����Ե���У�����������ʧ�������������ӣ�������ӦʽΪ��2H2-4e-�T4H+���ʴ�Ϊ��H2-2e-=2H+��
���� �����ۺϿ���ѧ�����ʺ�ƽ��ļ��㡢ƽ���ƶ�ԭ����Ӧ���Լ�ԭ��ع���ԭ����Ӧ��֪ʶ�������ۺ�֪ʶ�Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 200mL2mol/LMgCl2��Һ | B�� | 1000mL2.5mol/LNaCl��Һ | ||
| C�� | 300mL5mol/LFeCl3��Һ | D�� | 250mL lmol/L AlCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g����H=-a kJ/mol�� ��T��ʱ����һ������̶�Ϊ1L���ܱ������м���1mol CO��2mol H2����Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿ�ǿ�ʼʱ��3/5��
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g����H=-a kJ/mol�� ��T��ʱ����һ������̶�Ϊ1L���ܱ������м���1mol CO��2mol H2����Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿ�ǿ�ʼʱ��3/5���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | c��ClNO��/mol•L-1 | v/mol•L-1•s-1 |
| �� | 0.30 | 3.6��10-8 |
| �� | 0.60 | 1.44��10-7 |
| �� | 0.90 | 3.24��10-7 |
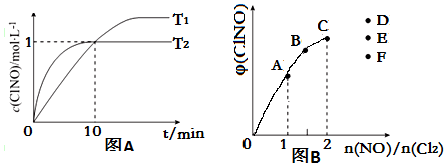
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com