
【题目】带有2个单位正电荷的微粒X2+,它的质量数等于137,中子数是81,则核外电子数为
A. 56 B. 54 C. 58 D. 137
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 分液漏斗可用于分离苯和水,且苯层由分液漏斗的下口流出
B. 利用丁达尔效应可以区分溶液与胶体
C. 用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,没有钾元素
D. 配制硫酸溶液时,可先在容量瓶中加入一定体积的浓硫酸,再在搅拌下慢慢加入水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,C是短周期中原子半径最大的。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是___________。C2B2所含的化学键类型有_____________;
(2)请写出C2B2与A2B反应的离子方程式,用单线桥法表示电子转移的方向和数目 ____________________________________________________。
(3)元素B、C形成的简单离子中半径较大的是___________(写电子式)。
(4)用电子式表示化合物C2D的形成过程:______________________________________。
(5)化合物M和N,都由A、B、C、D四种元素组成,它们在溶液中相互反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中前 4 周期的表格。
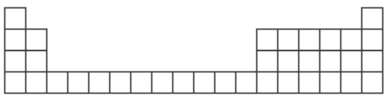
甲是一种常见化合物,其化学式为 XC13。
(1)根据你所学知识,将 X 代表的元素符号,填在所给周期表的表格中对应的位置__________(只写出2 种即可)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末 X2O3,则含碳的 X 合金在潮湿的(中性环境)空气中发生电化腐蚀时的正极反应式为__________。
(3)若 X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,该反应可用于_____。(写出一种用途);该元素的硫酸盐(约1 mol·L-1)和NaHCO3溶液(约1 mol·L-1)及起泡剂制成泡沫灭火剂。使用时发生的化学反应方程式是_______________________________,二者的体积比约是________。泡沫灭火器内的玻璃筒里盛 X 元素的硫酸盐溶液,为什么不能把它盛放在铁筒里________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )

A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态
C. 平衡时,体系的压强是开始时的1.8倍
D. 平衡时,Y的体积分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙互相分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
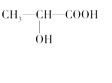
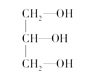
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1molSO2(g)和1molO2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:

①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com