
【题目】下列说法正确的是( )
A.BaSO4难溶于水,但BaSO4是强电解质
B.HClO具有强氧化性,HClO是强电解质
C.固体MgCl2不能导电,MgCl2属于非电解质
D.NH3的水溶液能导电,所以NH3是电解质
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】【2016年天津卷】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
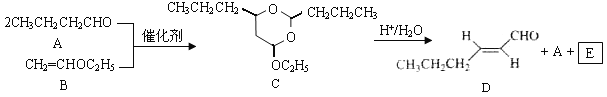
已知: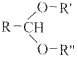
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
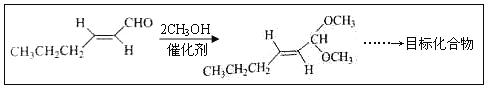
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
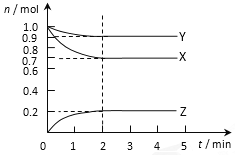
(1) 该反应的化学方程式为:_________________。
(2) 反应开始至2min,用Z表示的平均反应速率为:_________________。
(3) 在下列事实中,什么因素影响了化学反应的速率?
①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:__________;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体:_____________。
(4) 在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出乙醇分子的官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物。(填字母)
①能氧化成醛的是____________②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
(2)下列实验不能达到预期目的的是__________
A.实验室用无水乙醇加热至170℃,可制得乙烯
B.只用新制氢氧化铜悬浊液可将乙醇.乙醛.乙酸三种液体区别出来
C.在混有杂质苯酚的苯中.加入适量溴水.过滤后得到纯净的苯
D.在10%的NaOH溶液中滴入2%的CuSO4溶液至过量.再加入乙醛溶液加热至沸腾.溶液中有红色沉淀产生
E.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
F.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)

(3)实验室用50mL 0.50molL-1盐酸、50mL 0.55molL-1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.该有机物可以使溴水褪色,能和金属钠发生反应生成H2.求:
(1)该有机物的摩尔质量
(2)该有机物的分子式
(3)该有机物的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知我们所学的烃和烃的衍生物具有下列转化关系,请回答有关问题。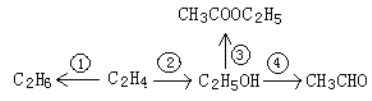
(1)写出以上三个反应的化学方程式(需注明反应所需的条件):
①__________________________________;
②__________________________________;
④__________________________________。
(2)在有机反应类型分类中,反应②属于______________,反应③属于___________。
(3)含有4个碳原子,与C2H6互为同系物的物质的分子式为_____________,写出该组成互为同分异构体的化合物的结构简式__________________,____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是( )
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是( )
A. 0.4 mol B. 0.6 mol C. 0.8 mol D. 1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com