
①E和K为无色气体单质,F为常见的金属,它在高温下与某些金属氧化物反应是工业上冶炼金属的方法之一。
②A为无色气体,B为淡黄色固体,C为无色液体。
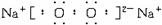
(1)写出以下物质的化学式:
A______________,H______________,I______________。
(2)写出B的电子式______________,固态G属于______________晶体。
(3)写出F+G+C![]() J+K的化学方程式:________________________。
J+K的化学方程式:________________________。
科目:高中化学 来源: 题型:
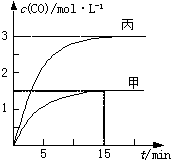 一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O |
1molCO 1molH2 |
4molC 2molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
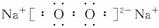
试回答下列问题:
(1)写出下列物质的化学式:A:____________,F:____________。
(2)写出B的电子式____________;A属于____________(填“极性”或“非极性”)分子。
(3)写出J→L的离子反应方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:0111 模拟题 题型:填空题
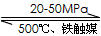 2NH3(g) △H=-192.0kJ·mol-1
2NH3(g) △H=-192.0kJ·mol-1 
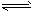 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com