
室温下,用0.100mol·L-1 NaOH溶液分别滴定20.00ml 0.100mol·L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
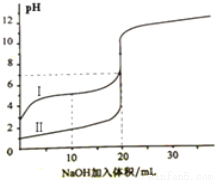
A. Ⅰ表示的是滴定盐酸的曲线
B.PH=7时,滴定醋酸消耗V(NaOH)小于20ml
C.V(NaOH) =20ml时,两份溶液中C(Cl—)== C(CH3COO—)
D.V(NaOH) =10ml时,醋酸溶液中:C(Na+ )> C(CH3COO—)> C(H+ )> C(OH—)
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源:2017届陕西省安康市高三上学期第一次月考化学试卷(解析版) 题型:实验题
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
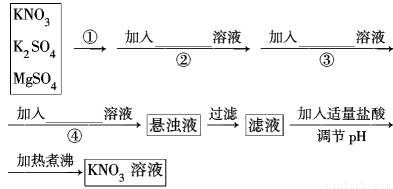
(1)操作①为_________________________。
(2)操作②~④加入的试剂依次可以为:______________________________
(3)如何判断SO42-已除尽? _
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,其理由是______________
(5)该同学的实验设计方案是否严密?请说明理由:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期暑假联考化学试卷(解析版) 题型:填空题
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为: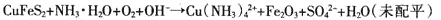
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。
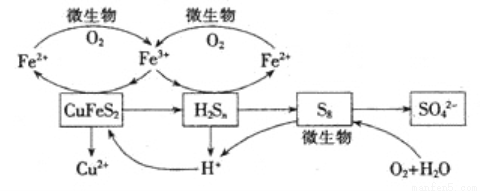
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期暑假联考化学试卷(解析版) 题型:选择题
除去下列物质中所含的杂质,选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | NaOH溶液 |
B | FeCl2溶液(FeCl3) | Fe粉 |
C | CO2(SO2) | Na2CO3溶液 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省南五校高三上学期第一次模拟考试化学试卷(解析版) 题型:填空题
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g)  2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的△H=_____kJ·mol-1
N2(g) + 2CO2(g)的△H=_____kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
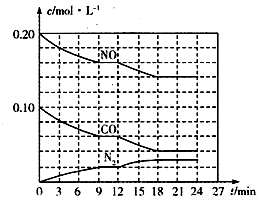
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
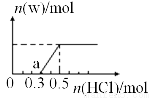
①O点溶液中所含溶质的化学式为_________________;
②a点溶液中各离子溶度大小关系为______________;
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期入学考理综化学试卷(解析版) 题型:推断题
有机物A(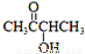 )有如下转化关系,且 1mol B反应生成了2mol C。
)有如下转化关系,且 1mol B反应生成了2mol C。
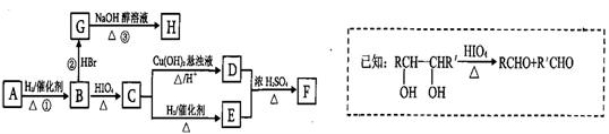
请回答下列问题:(1)C→E的反应类型为_______________________ 。
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为________。
(3)F的名称为
(4)写出C与银氨溶液反应的离子方程式为______ _________。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为:________________ 。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为_________________________.
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期入学考理综化学试卷(解析版) 题型:选择题
在常温下,发生下列几种反应:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
Cl2 + 2NaBr = 2NaCl + Br2 Br2 + 2FeBr2 = 2FeBr3
根据上述反应,下列结论正确的是( )
A.还原性强弱顺序为:Br—>Fe2+>Cl—
B.氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+
C.反应·中,当生成1molCl2 时,被氧化的HCl为3.2mol
D.溶液中可发生反应:2Fe3+ + 2Cl— = 2Fe2+ + Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高二(下)期末化学试卷(解析版) 题型:实验题
氢化阿托醛(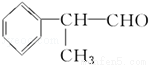 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下:
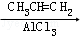

 [A]
[A]
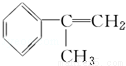

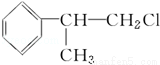
 [D](Mr=136)
[D](Mr=136)
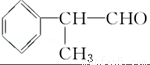
(1)在合成路线上①~⑤反应中,属于消去反应的为 (填反应序号).
(2)写出反应③、④的化学方程式: .
(3)在一定条件下,D与有机物X发生酯化反应生成E(Mr=164),则X的结构简式为 ,
写出满足下述两个条件的E的两种同分异构体的结构简式: .
a.属于羧酸 b.苯环上的一氯取代物只有一种结构.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二(下)期末化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.Cl2+2Br﹣═2Cl﹣+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应
B.2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均为水作还原剂的氧化还原反应
C.Cl元素的单质在化学反应中只表现氧化性
D.NaSO3与H2O2的反应为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com