
| A、2mol/L |
| B、1.5mol/L |
| C、3mol/L |
| D、7mol/L |
| 7.8g |
| 78g/mol |
| n(NaOH) |
| v |
| 0.3mol |
| 0.1L |
| n(NaOH) |
| v |
| 0.7mol |
| 0.1v |


科目:高中化学 来源: 题型:
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
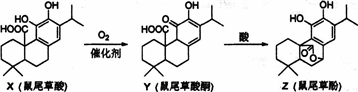
| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Y | Z | W | ||
| X | Q |
| A、元素Y、Z、W、Q均可与氢元素形成一种或多种氢化物,其中YH4中 H的质量分数最大 |
| B、由元素X与元素W组成的物质既能溶于足量的稀盐酸,又能溶于足量的氨水 |
| C、元素Y、Z、W的单质晶体一定是同种类型的晶体 |
| D、为了增强Q单质水溶液的漂白性,可将与W同主族且相邻的元素的低价氧化物通入其中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤转化为气态燃料,可以降低碳的排放 |
| B、甲醇的沸点是64.5℃,甲醇中的水分可采用蒸馏法分离 |
| C、工业上利用饱和的K2CO3溶液分离回收废气中的CO2,符合低碳经济理念 |
| D、采用内衬聚四氟乙烯的钢管输送合成气,可有效减缓钢管的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体氢氧化钠后,溶液中有c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | ||
B、加水稀释0.2 mol?L-1的醋酸溶液后,溶液中
| ||
| C、pH=3的弱酸HR溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应,反应后的溶液中一定有:c(R-)+c(HR)=0.05mol?L-1 | ||
| D、0.2 mol?L-1的CH3COOH溶液与0.1 mol?L-1NaOH溶液等体积混合后溶液呈酸性,则c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
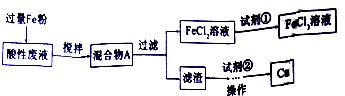
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com