
����Ŀ��ͼ1��ʾø�ʹ����ı仯ѧ��Ӧ���ʵ�ԭ��,ͼ2��ʾ�������Ƽ�����ʼ��Ӧ���ʵ�Ӱ�졣ø�����Ƽ�����ø��ϲ�����ø���Եķ��ӡ����������Ƽ�����ᄎ��ø�Ļ��Բ�λ,�Ǿ��������Ƽ���ø���Բ�λ���������λ����,�Ӷ�����ø�Ļ��ԡ���ش��������⡣
 ͼ1
ͼ1 ͼ2
ͼ2
(1)��ͼ1��֪,��ø���͵Ļ����______(��ͼ����ĸ��ʾ),�����������______________________,�����Ч�ʸ��ߡ�
(2)��ϸ������ø�ij�����________,��Ҫ��ԭ����________��
(3)ͼ2�ж�������____���ߵĽ��,����bΪ����_____���Ƽ�������,�ж�������_________________������ͼ2�л��������ø�ļ���������ߡ�________________
(4)�ź��ļ�˵��Ϊ,������ڵ���mRNA�ڷ���ʱ���Ⱥϳɵ���Nĩ�˴�����ˮ������л����ź���,����������Ĥ�ϵ�����ʶ����֮���ϡ��ź��ľ���Ĥ�е������γɵĿ�������������ǻ,��������ת���߶�����ӹ�ʱȴû���˸��ź������С��ݴ����ǿ����ƶ��������п��ܴ��ڵ�ø��������_______________��
(5)�ܵĺ�ϸ���ϳ�ø����Ҫ��ATP��Ҫ��_______(����)������
���𰸡���1��EB-EC ���ͻ�ܵ����ø�����
��2��ϸ���˻������ ���Ǻ��������
��3��A ������ �����Ũ�ȵ����ӣ������Ƽ���ϵ�ø�ı���ԽС�����������������ӽ����������Ӧ�ٶ�

��4�������е���ø�����ź�����ȥ
��5����������
�����������������
��1��������ͼ��֪����ø���Ļ�ѧ��Ӧ����Ҫ�Ļ��ΪEB����ø�ٷ�Ӧ�Ļ��ΪEC�����ø���͵Ļ��ΪEB-EC����һ��������Ļ�ѧ��Ӧ�����ȣ�ø���ͻ�ܵ����ø�������
��2������ø�Ļ�ѧ�����ǵ����ʻ�RNA����������Ϊ�������ϸ���ˣ������ʵĻ�����λΪ�����ᣬRNA�Ļ�����λΪ���Ǻ����ᣬ��˺ϳ�ԭ��Ϊ���Ǻ�������ᡣ
��3������ͼ�ұ�ʾ�������Ƽ�����ʼ��Ӧ���ʵ�Ӱ�죬��A����Ϊû�������Ƽ��ķ�Ӧ�������ߣ�Ϊ�����飬BCΪ�������Ƽ���Ӧ�������ߣ���������B�������Ũ�ȵ����ӣ�ø�ٷ�Ӧ�������ӣ�˵��BΪ���������Ƽ���������Ũ�Ƚϴ�ʱ�������Ƽ���ϵ�ø�ı�����С�����������������ӽ����������Ӧ���ʣ�����ø�ļ�����ﵽ���Ӧ��������Ҫ��ʱ���̣������Ӧ���ʲ��䣬���Ի��������𰸡�
��4���������⣬�ź��ľ���Ĥ�е������γɵĿ�������������ǻ����������ת���߶�����ӹ�ʱȴû���˸��ź������У�˵�������������е���ø�����ź�����ȥ��
��5�������ܵĺ�ϸ����ϸ���˺�ϸ������ATP����Ҫ��Դ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴Ӧ��N2(g)+3H2(g) ![]() 2NH3 (g)������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У����й��ڴ˷�Ӧ��˵���д������
2NH3 (g)������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У����й��ڴ˷�Ӧ��˵���д������
A. ���߷�Ӧ��ϵ���¶ȣ���ʹ��Ӧ���ʱ��
B. �÷�Ӧ��N2������100%ת��ΪNH3
C. �÷�Ӧ�ﵽƽ��״̬ʱ��N2��H2��NH3���ߵ�Ũ��һ�����
D. Ϊ�����H2��ת���ʣ����ʵ����N2��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ��ʶ��ʹ�õ������������ÿһ���˵��ճ�����绯ѧ���� SO2 ��Ŀǰ �о����ȵ㣬����˫��ˮ�������� SO2 ��Ŀǰ�о����ȵ㣮
��1����Ӧ���ܷ���ʽΪ�����ĵ缫��ӦʽΪ ��
��2��H+��Ǩ�Ʒ���Ϊ���� �� ������ҡ���
��3���� 11.2L����״����SO2 ���뷴Ӧ����Ǩ�� H+�����ʵ���Ϊ ��
��4�����л�ѧ��ز�����ɻ�����Ⱦ����
A.����ȼ�ϵ��
B.п�̵��
C.���ӵ��
D.Ǧ����
��5��ijͬѧ����ԭ��صıʼ��У����������� ��ԭ������缫 ������һ����ͬ
��ԭ��ظ������ϲ��뷴Ӧ���������϶������뷴Ӧ
��Fe��NaOH ��Һ��Si ԭ��أ�Fe �Ǹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʡ����ӵ�����ʽϿ��������ơ�����β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ����ִ���н�ͨ�ɵ���NOx��CO���س������ұ����Ѿ��з����⻯ѧ������Ⱦ��DZ��Σ�ա�
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪCxHy(��)��NO��NO2��O3��PAN (CH3COOONO2)���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������У����������_____________
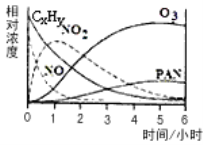
A��NO����ʧ�����ʱ�CxHy�� B��NO����NO2
C��CxHy��NO2��������PAN��O3 D��O3����PAN
��2��������ȼ������ʱ�����ĸ��»�����N2��O2�ķ�Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��

����ͼ��ʾ��T1��T2���ֲ�ͬ�¶��£�һ������NO�����ֽ������N2�����������ʱ��仯��ͼ����ͼ���жϷ�ӦN2(g)+O2(g) 2NO(g)Ϊ___________(��������������������)��Ӧ��
��2000��ʱ�����ݻ�Ϊ2L���ܱ������г���10 mol N2��5 mol O2���ﵽƽ���NO�����ʵ���Ϊ2 mol����2000��ʱ�÷�Ӧ��ƽ�ⳣ��K��____________�����¶��£�����ʼʱ�����������г���N2��O2��Ϊ1 mol����ﵽƽ���N2��ת����Ϊ_______________��
��Ϊ��������β���е��к�����Դ�������Ⱦ����������װβ������װ�á�����װ����װ�к�Pd�ȹ���Ԫ�صĴ����������ڴ�������������������õĻ�������ͼ��ʾ�� д�������仯�е��ܻ�ѧ��Ӧ����ʽ��________________________��
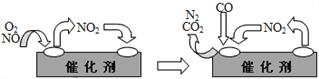
��3��������ϡ��ȼ�գ�ָ�����ڽϴ��/ȼ��(���������͵������)�����µ�ȼ�գݷ�����ʱ����ʱ�����ų�β���е���Ҫ��Ⱦ��ΪNOx��Ϊ����NOx���ŷţ�����������-��ԭ�ʹ�������CxHy(��)����ԭNOxҲ�����������������Ⱦ��
���磺CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g)�� ��H1����574 kJ/mol
CH4(g)��4NO(g) ��2N2(g)��CO2(g)+2H2O(g)�� ��H2
��1 mol CH4��ԭNO2��N2�����������зų�������Ϊ867kJ������H2��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5L���ܱ������У�һ�������·�����ѧ��Ӧ��2NO��g��+2CO��g��N2��g��+2CO2��g������ʼ��ӦʱNO��CO��Ϊ3mol�������ܱ�����������䣬10���Ӵﵽ��ѧƽ�⣬���N2Ϊ1mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ� ��
A.�ﵽƽ��������������ѹ��Ϊ2 L��������Ӧ���ʽ������淴Ӧ���ʽ���С
B.��Ӧǰ5�����ڣ���CO��ʾ��ƽ����Ӧ����Ϊ0.04 molL��1s��1
C.��v����CO��=2v����N2��ʱ���÷�Ӧ��NO�����ʵ������ٸı�
D.����ѹǿ���䣬�������г���1 mol He�������淴Ӧ���ʶ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵����ȷ����
A. 0.1mol/LNaHCO3��Һ��:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
B. 0.1mol/LHCN��0.1mol/LNaCN�ĵ���������Һ��:c(HCN)>c(Na+)>c(CN-)>c(H+)>c(OH-)
C. 0.1mol/LNa2C2O4��Һ�μ�HCl��Һ��c(H2C2O4)=c(HC2O4-):3c(H2C2O4)>c(OH-)+c(Cl-)
D. 0.1mol/LNH4HSO4��Һ�μ�NaOH��Һ��pH=7:c(Na+)=c(NH4+)+2c(NH3��H2O)>c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298 Kʱ���ϳɰ���ӦN2(g)��3H2(g)![]() 2NH3(g)����H����92.0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ) (����)
2NH3(g)����H����92.0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ) (����)
A. һ��С��92.0 kJ B. һ������92.0 kJ
C. һ������92.0 kJ D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��ijŨ�ȵ����ᷴӦʱ�����μӷ�Ӧ��п���������ʵ���֮��Ϊ2��5��������Ļ�ԭ���������
A. NO2 B. NO C. N2 D. NH4NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö��Ե缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42-��ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�����������ȷ����

A. ͨ����м���ҵ�SO42-����������Ǩ�ƣ���������ҺpH����
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ������ӦΪ2H2O�C4e�C=O2+4H+����������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com