
【题目】下列叙述不正确的( )
A.金属材料分为黑色金属材料和有色金属材料
B.活泼金属在空气中易与氧气反应,表面生成一层氧化膜均能保护内层金属
C.硅是一种亲氧元素,在自然界中它总是与氧相互化合的
D.氯是最重要的“成盐元素”,主要以NaCl的形成存在于海水和陆地的盐矿中
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】请回答与酶有关的问题.
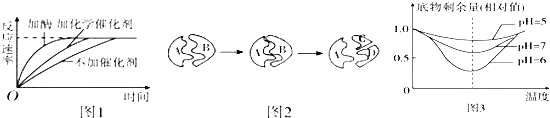
(1)如果图1和图2是与酶的特性相关的图示,那么图1和图2分别表示了酶具有 和 的特点.
(2)图3是与酶活性影响因素相关的曲线,请据图回答:当pH从5上升到7,酶活性的变化过程是 ;从图示曲线我们还可以得出的结论是随着pH的变化,酶的最适温度 .
(3)下表是有关淀粉酶的实验及不同条件下的实验结果,请根据实验结果回答下列问题.(注:人的唾液中含有淀粉酶,各试管保温时间相同)

①1号试管和3号试管实验结果相对照说明 .
②2号、4号试管与3号试管实验结果相对照说明 .
③5号试管与3号试管实验结果相对照说明 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检测酶X在37℃时对三种二糖(糖A、糖B、糖C)的作用,设计了如图所示的实验.5min后检测每只试管中的单糖和二糖,结果如下表.
试管1 | 试管2 | 试管3 | |
单糖 | 无 | 无 | 有 |
二糖 | 有 | 有 | 无 |

(1)一般来说,酶的基本组成单位是 .
(2)从本实验中,可得出的结论是: .
(3)为进一步检测该酶与pH的关系,请用下面所给的材料和实验室中的基本设备,设计一个实验,探究pH对酶活性的影响.
实验材料:酶X,糖A溶液、糖B溶液、糖C溶液(自选一种),斐林试剂,不同pH的物质(酸、水、碱).
实验步骤:
①取三支洁净试管,向三支试管中均加入1mL的酶X溶液,编号为A、B、C.
②向A试管中加入1mL ,向B试管中加入1mL ,向C试管中加入1mL ,摇匀.
③将 溶液各2mL注入到A、B、C三支试管中,置于 中保温5min.
④在各支试管中分别加入适量的 ,然后水浴加热5min,观察颜色变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
A. 苯不能使溴水褪色 B. 苯能与H2发生加成反应
C. 溴苯没有同分异构体 D. 对二溴苯只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A.a=3 B.a=2
C.B的转化率为40% D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于卤代烃RCH2CH2X性质叙述中,下列说法正确的是( )
A.发生水解反应的条件是强碱的醇溶液、加热
B.可以直接加硝酸银溶液检验卤素原子类型
C.发生消去反应生成烯烃
D.该卤代烃易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。

(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度B.加入催化剂(正)C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com