
| A、用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加人2-3 mL酚酞试液作指示剂 |
| B、用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH |
| C、测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 |
| D、在淀粉溶液中加入稀硫酸加热一段时间后,向其中滴加银氨溶液检验淀粉的水解产物 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温常压下,11.2L正丁烷所含共用电子对数为6.5NA |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有氢原子的数目为0.8NA |
| C、在50g质量分数为46%的乙醇水溶液中,含有氢原子总数为3NA |
| D、17 g羟基(-OH)所含有的电子数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| a |
| b |
| c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
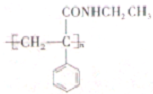
| H2O/H+ |
| △ |
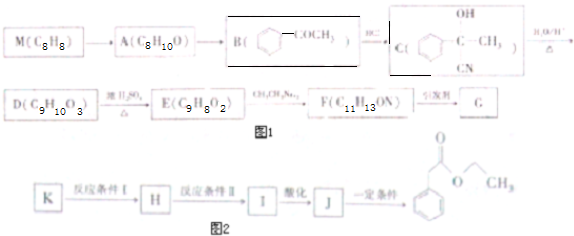
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com