
分析 n(XeO3)=n(Xe)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,n(Mn2+)=0.03L×0.1mol/L=0.003mol,结合氧化还原反应得失电子数目相等可确定Mn2+的氧化产物,进而书写反应的离子方程式,根据离子方程式计算.
解答 解:(1)n(XeO3)=n(Xe)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,n(Mn2+)=0.03L×0.1mol/L=0.003mol,令Mn2+氧化产物的化合价为+x,
0.0025mol×(6-0)=0.003mol×(x-2),
x=7,
答:氧化后锰元素的化合价为+7;
(2)由化合价的变化可知反应的离子方程式为5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+,
由反应的离子方程式可知生成的n(H+)=0.0025mol×$\frac{18}{5}$=0.009mol,则c(H+)=$\frac{0.009mol}{0.09L}$=0.1mol/L,pH=1,
答:稀释后溶液的pH为1.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、计算的考查,注意从化合价角度和习题信息角度分析,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
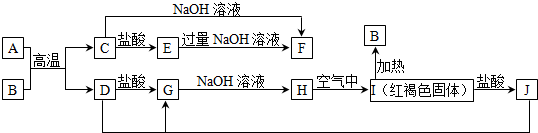
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键 分子间作用力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 分子间作用力 | D. | 分子间作用力 氢键 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
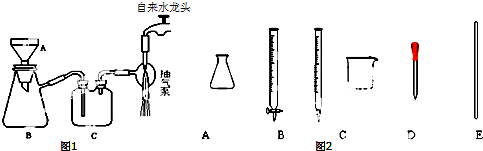
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
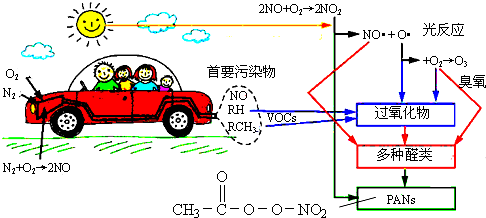
| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖属于有机高分子化合物 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com