
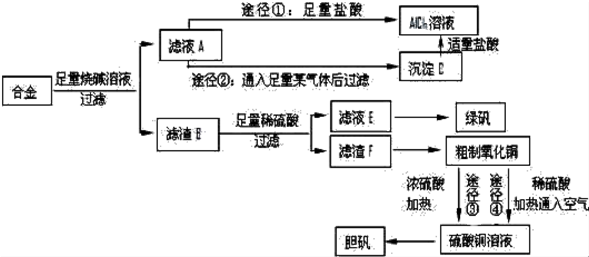
分析 由实验流程及物质的性质可知,含有铝、铁、铜的合金加入足量的氢氧化钠溶解,只有铝与氢氧化钠溶液反应,所以滤渣B为铁和铜,滤液中含有偏铝酸钠与剩余的NaOH,途径①加入足量的盐酸得到氯化铝溶液,途径②通入二氧化碳得到氢氧化铝沉淀,氢氧化铝用盐酸溶解得到氯化铝.滤渣B中用稀硫酸溶解,Cu不反应,过滤分离,滤渣F为Cu、滤液E中含有硫酸亚铁,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到绿矾.粗制氧化铜反应得到硫酸铜,再经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾.
(1)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,合金与烧碱溶液形成了原电池,Fe、Cu不与氢氧化钠溶液溶液;
(2)途径①所得的溶液中含有NaCl,途径②是利用氢氧化铝与盐酸反应得到氯化铝,氯化铝溶液在加热蒸发过程中应防止水解;
(3)途径③中Cu会与浓硫酸反应生成硫酸铜与二氧化硫,途径④中Cu与硫酸、氧气反应生成硫酸铜,结合消耗原料、环境保护等问题分析;
(4)酸性条件下,氧气与粗制氧化铜中的Cu反应得到Cu2+,过滤除去不溶物后,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾;
(5)先称量样品与坩埚质量,再加热分解,称量加热后总质量,两次处理误差在系统误差范围内,说明完全失去结晶水,至少进行4次质量称量;结合加热前后的固体的质量差为水的质量分析x的值变化.
解答 解:含有铝、铁、铜的合金加入足量的氢氧化钠溶解,只有铝与氢氧化钠溶液反应,所以滤渣B为铁和铜,滤液中含有偏铝酸钠与剩余的NaOH,途径①加入足量的盐酸得到氯化铝溶液,途径②通入二氧化碳得到氢氧化铝沉淀,氢氧化铝用盐酸溶解得到氯化铝.滤渣B中用稀硫酸溶解,Cu不反应,过滤分离,滤渣F为Cu、滤液E中含有硫酸亚铁,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到绿矾.粗制氧化铜反应得到硫酸铜,再经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾.
(1)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,合金与烧碱溶液形成了原电池,Fe、Cu不与氢氧化钠溶液溶液,则Al作负极,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al;
(2)途径①所得的溶液中含有NaCl,途径②是利用氢氧化铝与盐酸反应得到氯化铝,制得氯化铝比较纯,途径②更合理,氯化铝溶液在加热蒸发过程中应防止水解,具体操作为:将溶液低温蒸发浓缩过滤,所得固体在氯化氢的氛围里蒸干,
故答案为:途径②;将溶液低温蒸发浓缩过滤,所得固体在氯化氢的氛围里蒸干;
(3)途径③中Cu会与浓硫酸反应生成硫酸铜与二氧化硫,途径④中Cu与硫酸、氧气反应生成硫酸铜,与途径③相比,途径④明显具有的两个优点是:产生等量胆矾途径④消耗硫酸少、途径④不会产生污染大气的气体,
故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;
(4)酸性条件下,氧气与粗制氧化铜中的Cu反应得到Cu2+,反应离子方程式为2Cu+O2+4H+=2Cu2++2H2O,过滤除去不溶物后,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾,
故答案为:加热浓缩;过滤;2Cu+O2+4H+=2Cu2++2H2O;
(5)先称量样品与坩埚质量,再加热分解,称量加热后总质量,两次处理误差在系统误差范围内,说明完全失去结晶水,至少进行4次质量称量;
a.加热温度过高,硫酸铜可能分解,测定结晶水质量偏大,导致x值偏高;
b.胆矾晶体的颗粒较大,结晶水不能完全失去,测定结晶水质量偏小,导致x值偏低;
c.加热后放在空气中冷却,有吸收空气中水蒸气,测定结晶水质量偏小,导致x值偏低;
d.胆矾晶体部分风化,晶体中结晶水的质量偏小,导致x值偏低;
e.加热时胆矾晶体飞溅出来,失去的晶体全部按结晶水质量计算,测定结晶水质量偏大,导致x值偏高;
f.所用坩埚事先未干燥(潮湿),沉淀结晶水的质量偏大,导致x值偏高,
故答案为:4;aef.
点评 本题考查物质的制备实验,为高频考点,把握实验流程中发生的反应、物质的性质、混合物分离提纯方法等为解答的关键,侧重分析与实验能力的综合考查,注意氧化还原反应、原电池、盐类水解的应用,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有 10 个中子的氧原子:${\;}_{8}^{16}$O | |
| B. | 氢氧根离子的电子式: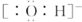 | |
| C. | 基态 Cr 的价电子排布式为:3d44s2 | |
| D. | 某元素原子的电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
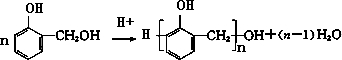
 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下: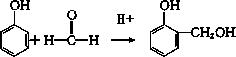
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08 g | B. | 1.28 g | C. | 2.16 g | D. | 4.32 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com