
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
根据下列框图分析,下列说法正确的是( )
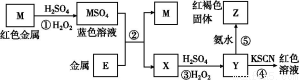
A.E3+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN-+E3+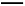 E(SCN)3↓
E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.浓度均为0.1 mol·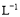 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
c(CH3COOH)+c(CH3COO-)=0.2 mol·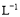
B.0.1 mol·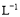 NaHCO3溶液中:c(Na+)=c(HC
NaHCO3溶液中:c(Na+)=c(HC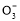 )+c(H2CO3)+2c(C
)+c(H2CO3)+2c(C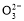 )
)
C.0.2 mol·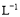 HCl溶液与等体积的0.1 mol·
HCl溶液与等体积的0.1 mol·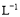 NaOH溶液混合后,溶液的pH=1
NaOH溶液混合后,溶液的pH=1
D.0.1 mol·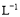 氨水中滴入0.1 mol·
氨水中滴入0.1 mol·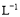 盐酸至溶液呈中性时,混合溶液中:c(N
盐酸至溶液呈中性时,混合溶液中:c(N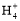 )=c(Cl-)
)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
图甲中电极均为石墨电极,下列叙述中正确的是( )
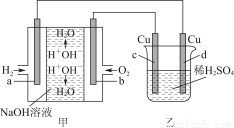
A.电子沿a→d→c→d路径流动
B.b极的电极反应为O2+4e-+4H+=2H2O
C.通电初期乙中的总反应为Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
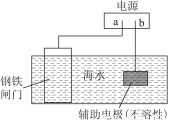
A.图中所示是牺牲阳极的阴极保护法
B.铁闸门作阴极,发生还原反应
C.电子流向:a→铁闸门→辅助电极→b
D.辅助电极上的反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
盐MN溶于水的过程如图所示:

下列说法不正确的是( )
A.MN是强电解质
B.N-结合H+的能力一定比OH-强
C.该过程中c(OH-)>c(H+)
D.溶液中存在c(HN)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________
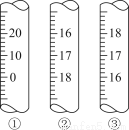
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:填空题
新的《环境空气质量标准》将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因________________________________________
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)??N2(g)+2CO2(g)的ΔH=________kJ·mol-1;该反应的ΔS________0(填“>”“<”或“=”)。
(3)将0.20 mol NO和0.10 mol CO充入一个容积恒定为1 L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
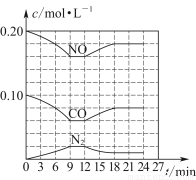
①计算产物N2在6~9 min时的平均反应速率v(N2)=________mol·L-1·min-1;
②第12 min时改变的反应条件为________(填“升温”或“降温”);
③计算反应在第24 min时的平衡常数K=________。若保持温度不变,再向容器中充入CO、N2各0.060 mol,平衡将________移动(填“正向”“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20 ℃的数据如下表:
溶解度(S)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
①吸收SO2最合适的试剂是________[填“Ca(OH)2”或“Ba(OH)2”]溶液;
②在20 ℃时,向CaSO3悬浊液中滴加适量的BaCl2溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的 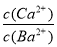 =____________(写出表达式即可)。
=____________(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列有关的离子方程式中正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:Cu+2H+ Cu2++H2↑
Cu2++H2↑
C.磷酸一氢钠溶液水【解析】
HPO42—+H2O PO43—+H3O+
PO43—+H3O+
D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com