
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 | |
| Ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,有刺激性气味 |
分析 无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,因硝酸具有强氧化性,则无色溶液应为NaOH溶液,
(1)加入铝粉产生H2,Al失去电子,H得到电子;
(2)①盐酸与氧化铝反应生成氯化铝和水;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质;Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水;
(3)用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为氨气,碱性条件下Al与NO3-发生氧化还原反应生成氨气;
(4)根据实验结果可知,溶液中一定不存在硝酸根离子,再结合电荷守恒可知溶液中一定存在氢氧根离子,最后结合离子共存判断溶液中一定存在的阳离子.
解答 解:无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,因硝酸具有强氧化性,则无色溶液应为NaOH溶液,
(1)加入铝粉产生H2,Al失去电子,H得到电子,则Al为还原剂,具有还原性,故答案为:还原性;
(2)①盐酸与氧化铝反应生成氯化铝和水,该离子反应为:6H++Al2O3═2Al3++3H2O,故答案为:6H++Al2O3═2Al3++3H2O;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质,
a.由上述分析可知,浅棕色气体是NO2,故答案为:NO2;
b.Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水,反应的离子反应为:Al+NO3?+4H+═Al3++NO↑+2H2O,故答案为:Al+NO3?+4H+═Al3++NO↑+2H2O;
(3)①用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为NH3,故答案为:NH3;
②由上述分析可知,碱性条件下Al与NO3-发生氧化还原反应生成氨气,离子反应为8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-,
故答案为:8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-;
(4)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物,则溶液中一定不存在NO3?;根据溶液电中性可知,溶液中一定存在阴离子OH-,则一定不存在大量的H+,故溶液中一定存在的离子为:K+、OH-,
故答案为:K+、OH-.
点评 本题考查物质中的组成及性质,为高频考点,题目难度中等,把握实验方案的设计及发生的氧化还原反应为解答的关键,注意设计思路与物质性质的关系,侧重实验学生分析能力、综合应用能力的考查,较好考查学生实验基本技能.


科目:高中化学 来源: 题型:选择题
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向某未知溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 用一束强光照射Na2SiO3溶液 | 溶液中出现一条光亮的通路 | 溶液中可能含有硅酸胶体 |
| C | 向盛有Fe(NO3)2溶液的试管中滴入几滴0.1mol/LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 淀粉溶液中加稀硫酸,加热片刻后再滴加银氨溶液,并用水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应类型取代反应.
,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:2 | C. | 3:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
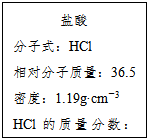 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com