
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;

请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为____________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________________________________ _________________________________________________________________,
从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1________L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
解析 (1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2。Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀。
(2)Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液。
(3)m(Al2O3)=1 000 kg×36%=360 kg,m(H2SO4)= kg=1 037.6 kg,需消耗质量分数98%的硫酸(密度1.84 g·cm-3)为
kg=1 037.6 kg,需消耗质量分数98%的硫酸(密度1.84 g·cm-3)为 =575.4×103 mL=575.4 L。
=575.4×103 mL=575.4 L。
(4)设制得的Al2(SO4)3和NH4Al(SO4)2·12H2O的物质的量都是1 mol,则Al3+共3 mol,SO42-共5 mol,根据铝原子和SO42-守恒原理可得,加入Al2O3和H2SO4的物质的量之比为 ∶5=3∶10。
∶5=3∶10。
答案 (1)SiO2 AlO2-+CO2+2H2O===HCO3-+Al(OH)3↓ (2)Al2O3+4H2SO4+2 NH3===2NH4Al(SO4)2+3H2O 蒸发浓缩 (3)575.4 (4)3∶10
NH3===2NH4Al(SO4)2+3H2O 蒸发浓缩 (3)575.4 (4)3∶10


科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ▲ ,试样的pH= ▲ 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 ▲ (填字母)。
a. Ca(OH)2 b. Na2CO3 c. CaCl2 d. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。
2C(s)+O2(g)。
已知该反应的ΔH>0,简述该设想能否实现的依据 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列说法正确的是 ( )。
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1 NA
B.常温常压下,18 gH2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1  NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应对应的离子方程式书写正确的是 ( )。
A.漂白粉露置在空气中失效:ClO-+CO2+H2O===HClO+HCO3-
B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO42-+OH-===BaSO4↓+H2O
C.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3===2FeO42-+3Cl-+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中评价正确的是 ( )。
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 向NaAlO2溶液中通入过量的CO2:AlO2-+2CO2+H2O===Al3++2HCO3- | 正确 |
| B | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+SO42- | 错误,CuSO4应拆分成离子形式 |
| C | 向盐酸中滴入氨水:H++O | 正确 |
| D | 硫化钠的第一步水解:S2-+H2OHS-+OH- | 错误,应该为S2-+2H2O H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.B、C、D的最高价氧化物对应的水化物能相互反应
D.元素B和C的最高价氧化物对应水化物的碱性:C>B
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯甲醛与乙酸酐[(CH3CO)2O]在一定条件下可以通过Perkin反应生成肉桂酸,反应方程式(已配平)如下:
苯甲醛 肉桂酸
(1)1mol苯甲醛与足量银氨溶液在水浴条件下反应最多能生成_____ _mol银单质;写出肉桂酸完全加氢后产物的分子式 。
(2)上述反应中的产物M能与碳酸氢钠反应并放出气体,则M的结构简式是 。
(3)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,其反应方程式为
(不要求标出反应条件),该反应类型属于_______________。
 |
(4)已知具有五元环和六元环结构的缩醛比较稳定。写出用乙二醇(HOCH2CH2OH)保护苯甲醛中醛基生成的缩醛B(分子式:C9H10O2)的结构简式_________________。
(5)缩醛B(分子式:C9H10O2)符合以下条件的同分异构体有两种,写出它们的结构简式_________ ____。
①苯环上只有一个取代基;②能发生水解反应和银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应:Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O===10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.还原性 :CoCl2>HCl>I2
:CoCl2>HCl>I2
D.氧化性:Co2O3>Cl2>HIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g)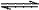 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度;
(2) B的转化率;
(3) x的值。(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com