
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )
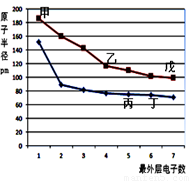
A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应
B.气态氢化物的稳定性:丙>丁>戊
C.甲的离子半径比丁的简单离子半径小
D.乙与丁形成的化合物含共价键,同时是两性氧化物
AC
【解析】
试题分析:单质硅是半导体,则乙是硅;以此为突破口,图中与硅同周期且原子最外层电子数为1的甲是钠,原子最外层电子数为7的戊是氯;硅的上一周期且原子最外层电子数为5的丙是氮,原子最外层电子数为6的丁是氧。丙是氮,氮的氢化物是氨气,氮的最高价氧化物的水化物是硝酸,氨气与硝酸容易发生化合反应,生成硝酸铵,故A正确;丙、丁、戊分别是氮、氧、氯,氧无最高正价,合成氨是可逆反应,氢气与氯气反应是不可逆反应,则非金属性:N<Cl<O,非金属性越强,气态氢化物越稳定,则NH3<HCl<H2O,故B错;甲、丁分别是钠、氧,核电荷数分别是11、8,钠离子和氧离子都具有28电子层结构,电子层数相同,核电荷数越大,离子半径越小,则钠离子半径小于氧离子半径,故C正确;乙、丁分别是硅、氧,都是非金属,二者以共价键形成的化合物是二氧化硅,二氧化硅是酸性氧化物,不是两性氧化物,故D错。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质的综合推断等。


科目:高中化学 来源: 题型:阅读理解
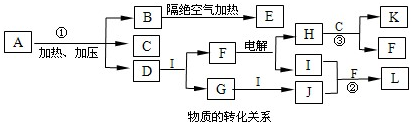


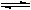 NH4++NH2-
NH4++NH2-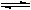 NH4++NH2-
NH4++NH2-查看答案和解析>>
科目:高中化学 来源:江山市模拟 题型:填空题

查看答案和解析>>
科目:高中化学 来源:2012届甘肃省西北师大附中高三第一学期期中考试化学试卷 题型:填空题
(16分)有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系,据此回答下列问题:
⑴X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式__________;②写出Z与甲反应的化学方程式_____________。
⑵X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式____________________________。
②Z与甲的反应的一种重要工业用途是____________________________。
③在①所得溶液中加入乙的溶液,观察到的现象____________________________。
⑶X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式____________________________;
②将①所得溶液与小苏打溶液的混合观察到的现象____________________________;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com