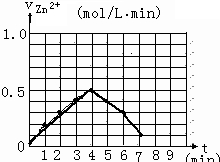
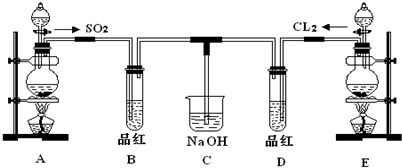
某化学实验小组的同学为探究和比较SO
2和氯水的漂白性,设计了如下的实验装置.

(1)实验室用装置A制备SO
2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
分液漏斗的玻璃塞没有取下来
分液漏斗的玻璃塞没有取下来
;
(2)实验室用装置E制备Cl
2,其反应的离子方程式为:
MnO
2+2Cl
-+4H
+Mn
2++Cl
2↑+2H
2O
MnO
2+2Cl
-+4H
+Mn
2++Cl
2↑+2H
2O
.若有6mol的HCl参加反应,则转移的电子总数为
3×6.02×1023
3×6.02×1023
;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
品红褪色
品红褪色
,D:
品红褪色
品红褪色
.
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
褪色的品红又恢复成红色
褪色的品红又恢复成红色
,D:
无明显现象
无明显现象
.
(4)另一个实验小组的同学认为SO
2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO
2和Cl
2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用离子方程式表示)
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.







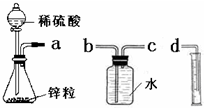 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.