
【题目】人类对原子结构的探究经历了多个历史阶段.下列各阶段的先后顺序正确的是( )
①徳谟克利特提出的古典原子论 ②道尔顿提出的近代原子论
③卢瑟福提出原子结构的“行星模型”④汤姆逊提出原子结构的“葡萄干面包模型”
A.①②③④
B.①②④③
C.①③④②
D.④③①
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
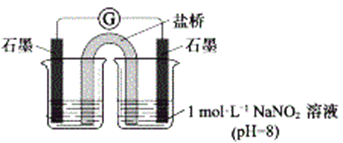
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
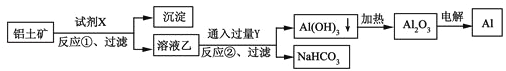
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
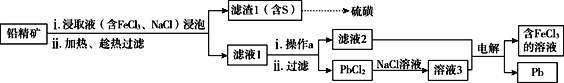
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
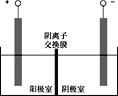
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物B.该物质一定含钠离子
C.该物质一定是金属钠D.不能确定该物质是否含钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele),如图甲。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenyonl),如图乙。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
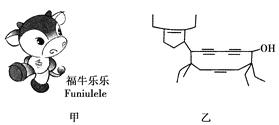
A. 牛式二烯炔醇含有三种官能团
B. 牛式二烯炔醇含有三个手性碳原子
C. 1 mol 牛式二烯炔醇最多可与6 mol Br2发生加成反应
D. 牛式二烯炔醇分子内能发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com