
分析 (1)依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积,依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(2)A.容量瓶带有活塞,使用前应检查是否漏水;
B.依据定容的正确操作解答;
C.容量瓶不能用来稀释溶液;
D.依据摇匀的正确操作解答;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol/L×V=100mL×1.0mol/L,解得V=5.6mL;
据配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,量取5.6mL浓硫酸需要使用10mL量筒,
故答案为:BEFGH;
(2)A.容量瓶带有活塞,使用前应检查是否漏水,故A正确;
B.定容时,应将蒸馏水注入容量瓶中,液面离刻度线下1~2cm时,改用胶头滴管滴加至凹液面与刻度线相切,故B正确;
C.容量瓶不能用来稀释溶液,所以应先在烧杯中稀释再转移到容量瓶,故C错误;
D.定容后盖好瓶塞,反复上下颠倒,摇匀,故D正确;
故选:C;
(4)A.定容时俯视读数,导致溶液体积偏小,溶液浓度偏高,故A选;
B.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.洗涤量筒,并将洗涤液转入容量瓶,导致溶质的物质的量偏大,溶液浓度偏高,故C选;
D.在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故D选;
故选:ACD.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.


科目:高中化学 来源: 题型:选择题
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1mol•L-1 醋酸与中和100 mL 0.01mol•L-1 的醋酸所需同种碱溶液的用量不同 | |
| B. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
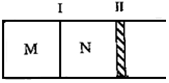 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com