
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
分析 A.硫酸氢钠与少量氢氧化钡:2 NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4;硫酸氢钠与过量氢氧化钡:NaHSO4+Ba(OH)2 =BaSO4↓+NaOH+H2O;
B.Ba(OH)2与H2SO4反应生成硫酸钡和水,与反应物用量无关;
C.二氧化碳少量反应生成碳酸钙和水,二氧化碳过量反应生成碳酸氢钙;
D.氢氧化钠少量反应生成碳酸钙、碳酸氢钠和水,氢氧化钠过量反应生成碳酸钠、碳酸钙和水.
解答 解:A.硫酸氢钠与少量氢氧化钡:2 NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4;硫酸氢钠与过量氢氧化钡:NaHSO4+Ba(OH)2 =BaSO4↓+NaOH+H2O,二者反应实质不同,不能用同一个离子方程式表示,故A错误;
B.Ba(OH)2与H2SO4反应生成硫酸钡和水,与反应物用量无关,无论谁过量,都可以用同一离子方程式表示,故B正确;
C.二氧化碳少量反应生成碳酸钙和水,二氧化碳过量反应生成碳酸氢钙,二者反应实质不同,不能用同一个离子方程式表示,故C错误;
D.氢氧化钠少量反应生成碳酸钙、碳酸氢钠和水,氢氧化钠过量反应生成碳酸钠、碳酸钙和水,二者反应实质不同不能用同一个反应表示,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查反应物用量对反应的影响,明确反应实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子的稳定性与分子间作用力的大小无关 | |
| B. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
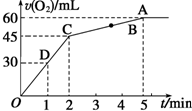 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com