
| A. | 矿泉水 | B. | 蒸馏水 | C. | 自来水 | D. | 雨水 |
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
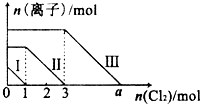 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
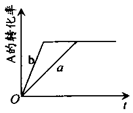 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com