
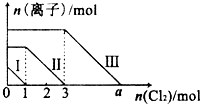
 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
分析 向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况.
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据溴离子判断溶液中n(FeBr2),根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值.
解答 解:向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况.
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol.
A、由上述分析可知,线段Ⅲ代表Br-的变化情况,故A错误;
B、溶液中n(Br-)=6mol,所以原混合溶液中n(FeBr2)=3mol,故B错误;
C、由上述分析可知,线段I代表I-的变化情况,故C错误;
D、由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故D正确;
故选D.
点评 本题考查氧化还原反应计算、氧化还原反应先后顺序、氧化性和还原性强弱比较,综合性较强,难度较大,清楚反应过程是解题关键.


科目:高中化学 来源: 题型:解答题

| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
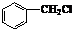
 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: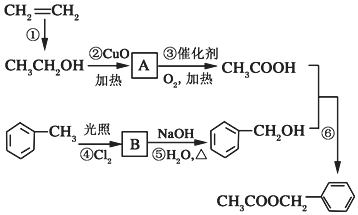
 ;
;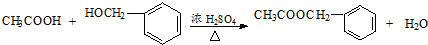 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
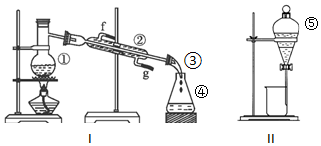
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com