
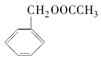
 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: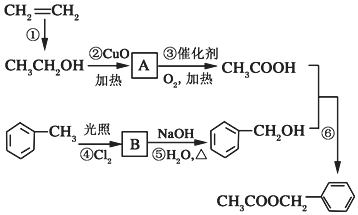
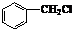 ;
;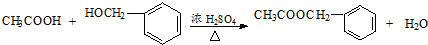 ;
;分析 根据各物质的转化关系可知,乙烯与水发生加成生成乙醇,乙醇在铜作催化剂、加热条件下,被氧化生成A为CH3CHO,CH3CHO被氧化生成乙酸,乙酸和苯甲醇反应生成乙酸苯甲酯,B和氢氧化钠的水溶液反应生成苯甲醇,甲苯和氯气在光照条件下发生取代反应生成B,则B是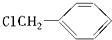 ,据此答题.
,据此答题.
解答 解:(1)乙醇与氧化铜加热反应生成A,A为CH3CHO,甲苯在光照条件下与氯气反应生成B,B为 ,
,
故答案为:CH3CHO; ;
;
(2)反应②是乙醇被氧化物为乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应⑥是乙酸与苯甲醇发生酯化反应生成乙酸苯甲酯,反应方程式为 ,
,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;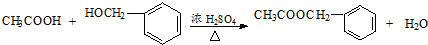 ;
;
(3)苯甲醇的同分异构体(不包过它本身且含苯环)为苯环上连有-CH3和-OH,它们有邻间对三种位置关系,或苯环上连有-OCH3,共有4种,故答案为:4.
点评 本题考查有机物的推断,水解烯烃、卤代烃、醇、醛、羧酸的性质及转化,难度中等,掌握常见有机物的性质是解答的关键,注意苯的同系物在光照条件下与氯气发生在支链上,取代在催化剂的条件下发生在苯环上取代.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| t/min | 平衡时的热量变化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一组 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二组 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K为已知反应的平衡常数,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同温度下,在第二组平衡后的混合气体中再加入2molHI,重新达到平衡后,HI的转化率为21.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO是还原剂 | B. | Fe2O3被还原 | ||
| C. | 属于氧化还原反应 | D. | 属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
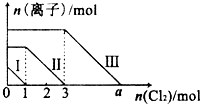 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
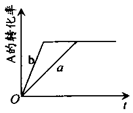 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com