
| m |
| M |
| m |
| M |
| 27g |
| 135g/mol |
| 0.4mol |
| 2.5mol/L |
| 0.2mol |
| 1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
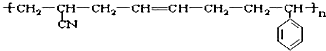 其单体可能是( )
其单体可能是( )| A、①③⑤ | B、②③⑤ |
| C、①②⑥ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO2在反应中被氧化 |
| B、NaI是还原产物 |
| C、若反应过程中转移2mole-,则生成标准状况下NO的体积为44.8L |
| D、氧化剂与还原剂之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
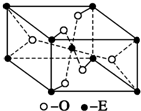 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量 | B、摩尔质量 |
| C、质量分数 | D、物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 相关信息 |
| X | 基态原子核外只有一种运动状态的电子 |
| Y | 用于自来水的消毒,单质黄绿色气体 |
| Z | 核素质量数为23,中子数为12,化合物焰色为黄色 |
| W | 常见的工业用量最大的金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com