
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
(1)2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O
(2)bdc
(3)①Na2S>NaHCO3>NaF>NaClO2;后者大②CuS;6.3×10-13mol/L
(4)4OH--4e-=2H2O+O2↑ 0.2mol
【解析】亚硫酸钠、氯酸钠和硫酸反应生成了二氧化氯气体,氯酸钠做氧化剂,亚硫酸钠做还原剂,再结合离子方程式的电荷守恒可得离子方程式;
(2)从溶液中得到晶体需经过蒸发浓缩、冷却结晶、过滤;
(3)①比较四种盐溶液的pH可转化为比较阴离子结合氢离子后生成的产物的电离程度,电离程度越小,对应阴离子的水解程度越大,即HClO2、HF、H2CO3、HS-的电离常数,电离常数越小,对应阴离子的水解程度越大,对应盐溶液的水解程度越大,pH越大。
②根据电荷守恒可得阴阳离子的总数等于阳离子总数的2倍,阳离子的总数等于钠离子的总数加氢离子的总数,钠离子总数相等,水解能力弱的溶液碱性弱,氢离子的浓度小,HClO2电离常数小,ClO2-的水解能力弱,氢离子的浓度小,故阳离子的总数小。②组成相似,ksp小的先析出,故先析出CuS;最后生成的为FeS,根据FeS的Ksp和亚铁离子的浓度为10-5mol/L,即可算出硫离子的浓度;(4)根据图示生成a气体的同时还能生成硫酸溶液,故氢氧根离子放电生成氧气,生成1mol氧气时转移4mol电子,故生成1.12L(标准状况)即0.05mol时转移0.2mol电子。


科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)几种
A.15 B.16 C.17 D.18
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
下列说法中不正确的是
A.光导纤维、硝化纤维、铜氨纤维、玻璃纤维的主成分都是糖类
B.生理盐水、葡萄糖注射液都不能产生丁达尔效应现象,不属于胶体
C.红外光谱仪可用于测定化合物的官能团、1H核磁共振仪可确定H所处的化学环境
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是
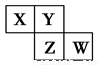
A.元素Y和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C.气态氢化物稳定性:X <Y<Z<W
D.元素W的最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:填空题
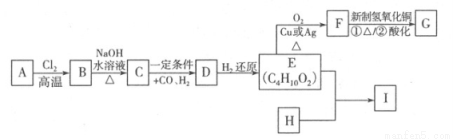
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
已知:① R—CH2—CH=CH2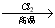 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2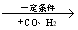 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是 ,E中的官能团的名称是 。
(2)写出A B的反应方程式 ,该反应类型是 。
B的反应方程式 ,该反应类型是 。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出E+H I的反应方程式 。
I的反应方程式 。
(4)关于G的说法中错误的是 (填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.1 mol G在一定条件下可与2 mol乙醇发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列各组离子一定能大量共存的是
A.加入铝粉有氢气产生的溶液中Na+ 、K+ 、SO42-、Cl- 、HCO3-
B.含有大量硝酸根离子的溶液中H+ 、Fe2+ 、SO42-、Cl-
、SO42-、Cl-
C.常温下,c(H+)/c(OH-) = 1×10-10 的溶液中NH4+ 、K+ 、Ca2+ 、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
某有机物的分子式为C4H8O2,有关其同分异构体数目的说法错误的是
A.属于酯类的有4种
B.属于羧酸的有2种
C.既含有羟基又含有醛基的有3种
D.存在分子中含有六元环的同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com