
【题目】对于反应8NH3+3Cl2=N2+6NH4Cl,下列说法正确的是( )
A.N2是还原产物,且还原剂与氧化剂物质的量之比是2:3
B.N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3
C.每转移6mol电子就生成22.4LN2
D.NH4Cl是氧化产物,且还原产物与氧化产物物质的量之比是1 : 6
科目:高中化学 来源: 题型:
【题目】SO2溶于水所得溶液的性质为( )
A.有氧化性,无还原性,无酸性
B.无氧化性,有还原性,无酸性
C.有氧化性,有还原性,有酸性
D.无氧化性,有还原性,有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法错误的是
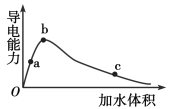
A.醋酸的电离程度:a<b<c
B.溶液的pH值:b>a>c
C.蘸取c点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D.若分别向a、b、c三点的溶液中,加入同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
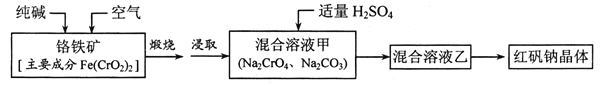
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入200 mL 0.03 mol·L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
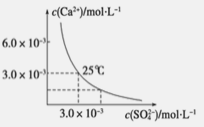
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO 42-)都变小
C.溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池负极发生的电极反应是还原反应
B.原电池是将化学能转化为电能的装置
C.原电池在工作时其正极不断产生电子经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com