
���� ��1������N=nNA����Ϸ��ӵ���ɼ��㣻
��2������n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$�����һ����̼��������̼���ӽṹ����ɽ��
��3������n=$\frac{m}{M}$��֪��������ȵ�SO2��SO3�����ʵ���֮����Ħ�������ɷ��ȣ�������Ŀ֮�ȵ������ʵ���֮�ȣ���Ϸ��Ӻ���ԭ��������Oԭ����Ŀ���
��4������n=$\frac{m}{M}$=c��V�����������������Һϡ��ǰ�����ʵ����ʵ����������ϡ�ͺ��Ũ�ȣ�
��5���ȸ��ݶ��۽���A���Ȼ���ķ���ʽ����Cl-�����ʵ�������Ȼ�������ʵ������ٸ��ݹ�ʽM=$\frac{m}{n}$��ȷ�����ӵ�Ħ��������Ħ����������ֵ�Ϻ���Է��������Ĵ�С��ȣ���������Է��������Ĵ�Сȷ������Ԫ�ص����ԭ��������
��6����ͬ�����£�����Ħ�������ȣ��������������ͬ������������ʵ�����ȣ�����n=$\frac{m}{M}$�����㣻
��7������c=$\frac{1000�Ѧ�}{M}$�������������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ʵ���Ũ�ȣ�
��� �⣺��1��1mol H2SO4�к���Hԭ�ӵ����ʵ���Ϊ2mol������ĿΪ1.204��1024������Oԭ��Ϊ4mol��
�ʴ�Ϊ��1.204��1024��4��
��2��2molCO��3molCO2������֮�ȣ�2mol��28g/mol��3mol��44g/mol=14��33������n=$\frac{N}{{N}_{A}}$��������֮�ȵ������ʵ���֮�ȣ�����2molCO��3molCO2�ķ�����֮��Ϊ2��3������ԭ�ӵ���Ŀ֮�ȣ�2mol��1��3mol��2=1��3���ʴ�Ϊ��14��33�� 2��3�� 1��3��
��3������n=$\frac{m}{M}$��֪��������ȵ�SO2��SO3�����ʵ���֮��=80g/mol��64g/mol=5��4���ʶ��ߺ��з�����Ŀ֮��Ϊ5��4������ԭ����Ŀ֮��=5��3��4��4=15��16�����ߺ���O���ʵ���֮��=5��2��4��3=5��6��
�ʴ�Ϊ��5��4��15��16��5��6��
��4��n��NaOH��=$\frac{20g}{40g/mol}$=0.5mol��c��NaOH��=$\frac{0.5mol}{0.5L}$=1mol/L��
��ҺΪ��һ�ȶ��Ļ�������ȡ��1mL�������ʵ���Ũ�Ȳ��䣬Ϊ1mol/L��
m��NaOH��=1mol/L��0.001L��40g/mol=0.04g��ȡ��1mL������Һ��n��NaOH��=1mol/L��0.001L=0.001mol��
��ˮϡ�͵�100mL��ϡ�ͺ���Һ��NaOH�����ʵ���Ũ����$\frac{0.001mol}{0.1L}$=0.01mol/L��
�ʴ�Ϊ��1��1��0.04��0.01��
��5����ij���۽������Ȼ���ACl2�к���0.4molCl-��֪���Ȼ���ACl2�����ʵ���Ϊ$\frac{0.4mol}{2}$=0.2mol��
��M��ACl2��=$\frac{m}{n}$=$\frac{19g}{0.2mol}$=95g/mol������ACl2��Է�������Ϊ95����A�����ԭ������Ϊ95-35.5��2=24���ʴ�Ϊ��95g/mol��24��95g��mol-1��
��6����������ʵ���=$\frac{58.8-50}{44}$=0.2mol��
��װ������ʱ���������Ϊ0.2mol��16g/mol=3.2g��
��װ��CH4����ʱ�����ܱ�����������50g+3.2g=53.2g��
�ʴ�Ϊ��53.2g��
��7����������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ�����Ũ��Ϊ��c=$\frac{1000��1.84��98%}{98}$mol/L=18.4mol/L���ʴ�Ϊ��18.4mol•L-1��
���� ���⿼�������ʵ����йؼ��㣬��ȷ�����ʵ���Ϊ���ĵļ��㹫ʽ����Ϥ���ʵĽṹ����ǽ���ؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | Ŀ�� | ���뷽�� |
| A | ��ȥͭ�������ͭ��[Cu2��OH��2CO3] | ��������ݣ�������ˮ��ϴ |
| B | ��ȥ�Ҵ��е�����ˮ | ����ʯ�ң������� |
| C | ��ȥ�Ȼ����к��������Ȼ��������� | ������ˮ |
| D | ��ȥNaCl�����е�NH4Cl | ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ������������Һ | B�� | �Ȼ�����Һ���������Һ | ||
| C�� | ̼�ᱵ��ϡ���� | D�� | ����������Һ������ͭ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��K+��+c��H+��=c��S2-��+c��HS-��+c��OH-�� | B�� | c��K+��+c��S2-��=0.3mol/L | ||
| C�� | c��K+��=2[c��S2-��+c��HS-��+c��H2S��] | D�� | c��OH-��=c��H+��+c��HS-��+c��H2S�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ڢ� | C�� | �٢� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢޢݢߢ� | B�� | �ܢޢۢߢݢ� | C�� | �ڢޢۢߢݢ� | D�� | �٢ޢۢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
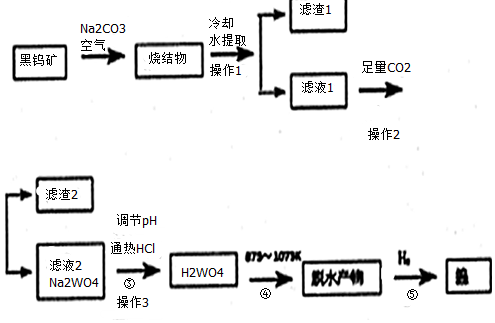
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com