
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
分析 氯化铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),氢离子浓度大于氢氧根离子浓度,溶液呈酸性;为了配制NH4+与Cl-的浓度比为1:1的溶液,须加一定量的能电离出铵根离子的物质,或减少溶液中氯离子的浓度,主要方法有:通入氨气,通过通入氨气以增加一水合氨浓度从而抑制铵根离子的水解;溶液中加入含铵根离子,不含氯离子的盐,如硝酸铵晶体,通过增加溶液中铵根离子的浓度,并保持氯离子浓度不变;加入适量硫酸,通过增加氢离子浓度抑制铵根离子的水解,但不可加盐酸,防止氯离子浓度也变大;加入适量硝酸银,减小溶液中氯离子浓度;据此即可解答.
解答 解:氯化铵是典型的强碱弱酸盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),溶液呈酸性,为了配制NH4+与Cl-的浓度比为1:1的溶液,须加一定量的酸性物质并保持氯离子浓度不变,抑制水解;或增加铵根离子浓度;或减少溶液中氯离子的浓度.
①适量NH4NO3,溶液中加入硝酸铵晶体后,增加溶液中铵根离子的浓度,并保持氯离子浓度不变,故①正确;
②适量NH4Cl,促进水解,导致c(NH4+)<c(Cl-),变得更大,故②错误;
③适量氨水,通过增加一水合氨浓度从而抑制铵根离子的水解,增加溶液中铵根离子的浓度,并保持氯离子浓度不变,故③正确;
④适量H2SO4,溶液中氢离子浓度增大,抑制了铵根离子的水解,但是铵根离子仍有少量水解,所以c(NH4+)<c(Cl-),故④错误;
故选B.
点评 本题主要考查了NH4Cl溶液的配制,解答须掌握铵根离子水解的影响因素,掌握盐类水解的规律是解答本类题的关键,本题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 32 g/mol | C. | 64 mol | D. | 64 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2F2的电子式: | |
| B. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I | |
| C. | 16O的原子结构示意图: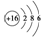 | |
| D. | 间羟基苯甲醛的结构简式: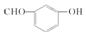 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 | |
| B. | 苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在1000时即可生成三硝基甲苯,说明苯环对甲基产生了影响 | |
| C. | 福尔马林(甲醇的水溶液)是混合物,可用来制作生物标本 | |
| D. | 除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,然后分液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L HCl | B. | 500mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com