
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
科目:高中化学 来源: 题型:实验题
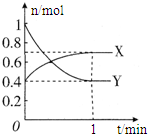 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 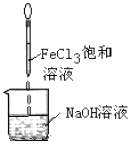 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
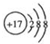 .
.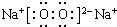 ,该产物所含有的化学键类型有离子键、非极性键.
,该产物所含有的化学键类型有离子键、非极性键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com