
分析 (1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,以此判断计量数关系;
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,说明该反应前后气体体积不变;
(3)升高温度,平衡向吸热方向移动,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动.
解答 解:(1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=n mol:n/2mol:3n/2mol:n mol=2:1:3:2,所以a、b、c、d分别为2、1、3、2,
故答案为:2;1;3;2.
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变,
反应2A+B?3 C+2D中,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;气体;
(3)升高温度,平衡向吸热方向移动;根据题意知,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力的考查,注意把握化学反应速率与化学计量数的关系,把握温度、压强对平衡移动的影响,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | △H1-△H2<0 | |
| B. | 反应②为放热反应 | |
| C. | 3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=-103.0 kJ•mol-1 | |
| D. | 3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 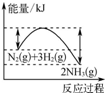 如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. | 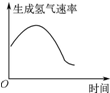 如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. | 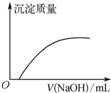 如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 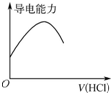 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
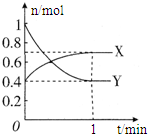 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应是吸热反应,则A为气态 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 改变压强对平衡的移动无影响 | |
| D. | 在平衡体系中加入少量C,则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿[Cu2(OH)2CO3] | 用盐酸浸泡,再用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去氯化铁中含有少量氯化亚铁杂质 | 加入溴水 |
| D | 除去NaCl固体中的NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com