
| 19.7g |
| 197g/mol |
| 0.1mol×106g/mol |
| 21.2g |


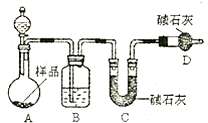
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
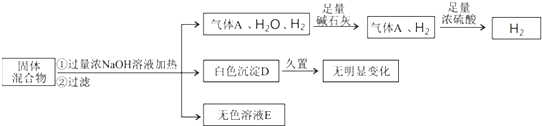
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只含碳、氢两种元素 |
| B.含碳、氢、氧三种元素 |
| C.肯定含碳、氢元素,可能含有氧元素 |
| D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.NaOH | C.AlCl3 | D.MgCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
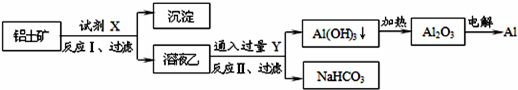
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
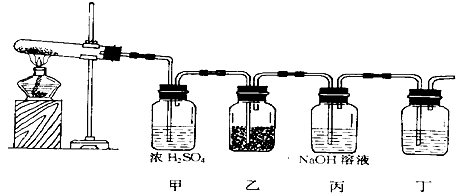
科目:高中化学 来源:不详 题型:实验题
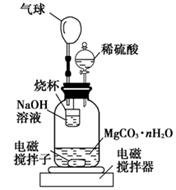
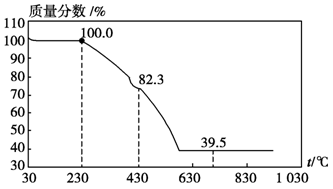
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com