
����Ŀ����֪T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ�����
Ԫ�� | �����Ϣ |
T | TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��� |
W | W��Tͬ���ڣ�������һ��δ�ɶԵ��� |
X | Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ��mol-1��I2=1817kJ��mol-1��I3=2745kJ��mol-1��I4=11575kJ��mol-1 |
Y | ���³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���� |
Z | Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34 |
��1��TY2��һ�ֳ��õ��ܼ�����__(�������Է����������Ǽ��Է�����)�������д��� ___��![]() ����W������⻯������Һ����������___��
����W������⻯������Һ����������___��
��2����25�桢101kPa�£���֪13.5g��X���嵥����O2����ȫȼ�պ�ָ���ԭ״̬������419kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__��
��3����̬Yԭ���У�����ռ�ݵ�����ܲ����Ϊ__�����ܲ���е�ԭ�ӹ����Ϊ___��������Ϊ___��Y������WԪ�صĵ縺���ɴ�С��˳��Ϊ___(��Ԫ�ط�������)��
��4����֪Z�ľ����ṹ��ͼ��ʾ����֪Z���ܶ�Ϊ9.00g��cm-3�����߳�Ϊ___��
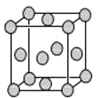
ZYO4�������Һ������YO42-�Ŀռ乹����__������Yԭ�ӵ��ӻ����������___��Z�ĵ���������������е������Լ�������Ӧ�����ɳ����Z+HCl+O2=ZCl+HO2��HO2(������![]() ������һ���������Ҳ��һ�����ɻ������м��ߵĻ��ԡ�����˵�����ʾ��ȷ����__��
������һ���������Ҳ��һ�����ɻ������м��ߵĻ��ԡ�����˵�����ʾ��ȷ����__��
A.O2�������� B.HO2����������
C.HO2�ڼ������ȶ����� D.1molZ�μӷ�Ӧ��1mol���ӷ���ת��
���𰸡��Ǽ��Է��� 2 ���������֮���������� 4Al(s)+3O2(g)=2Al2O3(s) ��H=-3352kJ/mol M 9 6 F>O>S 34.72��10-23 �������� sp3 AD
��������
T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��ʣ���TΪ̼Ԫ�أ�W��Tͬ���ڣ�������һ��δ�ɶԵ��ӣ�ԭ����������̼����������Ų�ʽΪ1s22s22p5����WΪ��Ԫ�أ�Xԭ�ӵĵ��ĵ����ܾ���������Xԭ����������������ӣ���XΪ��Ԫ�أ����³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���ʣ�����YΪSԪ�أ�Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34����Z��������Ϊ63-34=29������ZΪͭԪ�ء�
��1��AY2��ѧʽ��CS2����ṹʽΪS=C=S��Ϊֱ���ͽṹ��������������������غϣ����ڷǼ��Է��ӣ��������ÿ��˫���к���1��![]() ��������CS2���Ӵ���2��������WΪ��Ԫ�أ����ڷ��������֮���������������Է���������Һ�����ʴ�Ϊ���Ǽ��Է��ӣ�2�����������֮������������
��������CS2���Ӵ���2��������WΪ��Ԫ�أ����ڷ��������֮���������������Է���������Һ�����ʴ�Ϊ���Ǽ��Է��ӣ�2�����������֮������������
��2��13.5g��Al�����ʵ���Ϊ![]() =0.5mol��4molAl��O2��������ȫȼ�պ�ָ���ԭ״̬�ų�������Ϊ419kJ��
=0.5mol��4molAl��O2��������ȫȼ�պ�ָ���ԭ״̬�ų�������Ϊ419kJ��![]() =3352kJ�����Ȼ�ѧ����ʽΪ��4Al(s)+3O2(g)=2Al2O3(s) ��H=-3352kJ/mol���ʴ�Ϊ��4Al(s)+3O2(g)=2Al2O3(s) ��H=-3352kJ/mol��
=3352kJ�����Ȼ�ѧ����ʽΪ��4Al(s)+3O2(g)=2Al2O3(s) ��H=-3352kJ/mol���ʴ�Ϊ��4Al(s)+3O2(g)=2Al2O3(s) ��H=-3352kJ/mol��
��3��YΪ��Ԫ�أ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p4������ܲ����ΪM��M�ܲ����s��p��d�����ܼ���s����һ�������p�������������d����5��ԭ�ӹ�������Թ���9������ԭ�ӵ�����������Ϊ6��ͬ����������ҵ縺������ͬ�������϶��µ縺�Լ�С��S��O��FԪ�صĵ�һ�������ɴ�С˳��ΪF>O>S���ʴ�Ϊ��M��9��6��F>O>S��
��4��ZΪCuԪ�أ�ͭԭ��λ�ڶ�������ģ�ÿ�������к���ͭԭ�ӵ���ĿΪ��8��![]() +6��
+6��![]() =4�������к���4��ͭԭ�ӣ���������Ϊ��
=4�������к���4��ͭԭ�ӣ���������Ϊ��![]() g����þ����ı߳�Ϊxcm����þ������Ϊ��x3cm3����
g����þ����ı߳�Ϊxcm����þ������Ϊ��x3cm3����![]() g=x3��cm3��9.00g/cm3�������ɵ�x=34.72��10-23��SO42-���ӵ�����ԭ��S�ļ۲���Ӷ�Ϊ��4+
g=x3��cm3��9.00g/cm3�������ɵ�x=34.72��10-23��SO42-���ӵ�����ԭ��S�ļ۲���Ӷ�Ϊ��4+![]() =4���µ��Ӷ���Ϊ0������ռ�ṹΪ�������壬�ӻ������ĿΪ4��Sԭ���ӻ���ʽΪ��sp3��
=4���µ��Ӷ���Ϊ0������ռ�ṹΪ�������壬�ӻ������ĿΪ4��Sԭ���ӻ���ʽΪ��sp3��
A.O2����Ԫ�صĻ��ϼ���0�ۣ�HO2����Ԫ�ص�ƽ�����ϼ���-0.5�ۣ����ϼ۽���������������A��ȷ��
B.��ԭ������HO2����B����
C.HO2Ϊ�����ᣬӦ�������ԣ�����Ӧ����HO2�ڼ��в����ȶ����ڣ���C����
D.1molCu�μӷ�Ӧ����+1��ͭ���ӣ���1mol���ӷ���ת�ƣ���D��ȷ��
�ʴ�Ϊ��34.72��10-23���������壻sp3��AD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��8�¡�Green Chemistry���������ҹ�ѧ�߷����ĵ�ѹ��Ч�����ԭCO2���·��������ܷ�ӦΪNaCl��CO2![]() CO��NaClO�������йػ�ѧ�����ʾ�������(����)
CO��NaClO�������йػ�ѧ�����ʾ�������(����)
A.������Ϊ12����ԭ�ӣ�![]() NaB.Cl���Ľṹʾ��ͼ��
NaB.Cl���Ľṹʾ��ͼ��![]()
C.CO2�Ľṹʽ��O=C=OD.NaClO�ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1��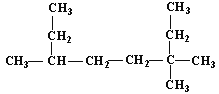 ������Ϊ___��
������Ϊ___��
��2��A�Ļ�ѧʽΪC4H9Cl����֪A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻��A������Ϊ___��
��3��2��4-���ȼױ��Ľṹ��ʽΪ___��
��4��ij���ʽṹ��ͼ��ʾ��̼ԭ����Ϊ___�������ʿ���������___(�����)������Ӧ��
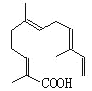
A.KMnO4������Һ B.���� C.��ˮ D.NaOH��Һ
��5���л���A�Ľṹ��ʽΪ��![]() ��A������������ˮ�����ɵķ����廯�����ж���ͬ���칹�壬��д�����к��б���(����������״�ṹ)�����ܷ���ˮ�ⷴӦ��������Ӧ��ͬ���칹���к˴Ź��������������Ľṹ��ʽ___��
��A������������ˮ�����ɵķ����廯�����ж���ͬ���칹�壬��д�����к��б���(����������״�ṹ)�����ܷ���ˮ�ⷴӦ��������Ӧ��ͬ���칹���к˴Ź��������������Ľṹ��ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����( )
A.���ɫ����![]() ȫ����������
ȫ����������![]()
B.ˮ��������![]() ��Һ�У�
��Һ�У�![]()
C.����Ũ�ȵ�![]() ��Һ��
��Һ��![]() Һ�������2:3��ϣ�
Һ�������2:3��ϣ�![]()
D.�����(��![]() )��84����Һ��Ϻ����������
)��84����Һ��Ϻ����������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ�����ճ�������Ӧ�ù㷺��ҽҩ֮һ��������������Ӧ���ɡ�
�����ǻ�����ȩ��һ���������������ǻ������
�����ǻ��������� CH3COCl ��Ӧ���ɰ�˾ƥ�֡�
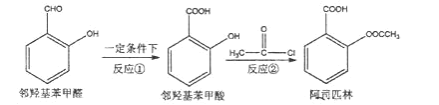
����˵����ȷ����( )
A.��Ӧ�ٿ�ʹ������ KMnO4 ��Һ��������
B.��Ӧ�ڵ���һ������ HCl
C.1mol ��˾ƥ�������Ժ� 2molNaOH ��Ӧ
D.���ǻ�����ȩ��������ͬһƽ���ϵ�ԭ�����Ϊ 12 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����Ƶ������г��������ʣ�Ӱ�������ʵļ��顣��ͼAΪ����װ�ã�BΪ���ʼ���װ�ã�������б���
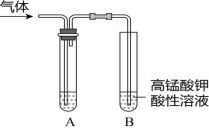
��� | ���� | ��Ӧԭ�� | A���Լ� |
�� | ��ϩ | ��ˮ�Ҵ���Ũ���Ṳ�ȣ���Ӧ�Ļ�ѧ����ʽ��______ | ___ |
�� | ��ϩ | ��������NaOH���Ҵ���Һ���ȣ���Ӧ�Ļ�ѧ����ʽ��_____ | ___ |
�� | ��Ȳ | ���ʯ�еμӱ���ʳ��ˮ����Ӧ�Ļ�ѧ����ʽ��___ | ____ |
��Ϊ̽������������ˮ�������ijͬѧȡ��С��ͬ��3֧�Թܣ��ֱ����������Һ�����������ͬһˮԡ�м�����ͬʱ�䣬�۲쵽��������
�Թܱ�� | �� | �� | �� |
ʵ����� |
|
|
|
ʵ������ | ����䱡 | ������ʧ | ����������� |
��1���Թܢ��з�Ӧ�Ļ�ѧ����ʽ��__________��
��2������Թܢ�ʵ���������/span>__________��
��3��ʵ�������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������50��60�����Ʊ��������ķ�Ӧװ����ͼ��ʾ�������й�˵��������ǣ� ��

A.���������ܵ�����������������ƽ��ѹǿ
B.�����Լ���˳���ȼ�Ũ���ᣬ�ټ�Ũ���ᣬ��ȴ����뱽
C.����Ӧ���Һ�嵹���ձ��У���ˮ
D.Ϊ�˳�ȥ���������е��������ʣ���Ҫˮϴ����ϴ��Ȼ����ˮϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z�ϳɻ���ҩ��M������˵������ȷ����
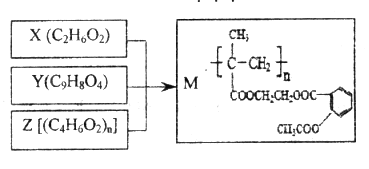
A. M�������ܻ�������ˮ�ⷴӦ
B. X��������ϩͨ���ӳɷ�Ӧ��ȡ����Ӧ�Ƹ�
C. 1molY��NaOH��Һ��Ӧ�����������3mol NaOH
D. Z�ɼӾ۷�Ӧ�Ƶã��䵥��Ľṹ��ʽ��CH3CH=CHCOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊԭ��������������Ķ���������Ԫ�ء���֪
Ϊԭ��������������Ķ���������Ԫ�ء���֪![]() ����
����![]() �γ�
�γ�![]() ��
��![]() �����
�����![]() ��
��![]() �γɵĻ�������γ����꣬
�γɵĻ�������γ����꣬![]() ��
��![]() ͬ���塣����˵����ȷ���ǣ� ��
ͬ���塣����˵����ȷ���ǣ� ��
A.![]() ����̬�⻯�����ȶ��ԣ�
����̬�⻯�����ȶ��ԣ�![]()
B.![]() ����̬�⻯������ȶ���ǿ��
����̬�⻯������ȶ���ǿ��![]() ����̬�⻯��
����̬�⻯��
C.![]() �����γ����ӻ�����
�����γ����ӻ�����
D.![]() �ļ����Ӱ뾶��
�ļ����Ӱ뾶��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com