
����Ŀ����ʵ�����Ƶ������г��������ʣ�Ӱ�������ʵļ��顣��ͼAΪ����װ�ã�BΪ���ʼ���װ�ã�������б���
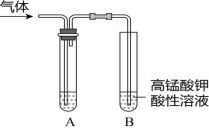
��� | ���� | ��Ӧԭ�� | A���Լ� |
�� | ��ϩ | ��ˮ�Ҵ���Ũ���Ṳ�ȣ���Ӧ�Ļ�ѧ����ʽ��______ | ___ |
�� | ��ϩ | ��������NaOH���Ҵ���Һ���ȣ���Ӧ�Ļ�ѧ����ʽ��_____ | ___ |
�� | ��Ȳ | ���ʯ�еμӱ���ʳ��ˮ����Ӧ�Ļ�ѧ����ʽ��___ | ____ |
��Ϊ̽������������ˮ�������ijͬѧȡ��С��ͬ��3֧�Թܣ��ֱ����������Һ�����������ͬһˮԡ�м�����ͬʱ�䣬�۲쵽��������
�Թܱ�� | �� | �� | �� |
ʵ����� |
|
|
|
ʵ������ | ����䱡 | ������ʧ | ����������� |
��1���Թܢ��з�Ӧ�Ļ�ѧ����ʽ��__________��
��2������Թܢ�ʵ���������/span>__________��
��3��ʵ�������__________��
���𰸡�CH3CH2OH ![]() CH2=CH2����H2O NaOH��Һ CH3CH2Br��NaOH
CH2=CH2����H2O NaOH��Һ CH3CH2Br��NaOH![]() CH2=CH2����NaBr+ H2O ˮ CaC2��2H2O��CH��CH����Ca��OH��2 CuSO4��Һ CH3COOC2H5��NaOH
CH2=CH2����NaBr+ H2O ˮ CaC2��2H2O��CH��CH����Ca��OH��2 CuSO4��Һ CH3COOC2H5��NaOH ![]() CH3COONa��C2H5OH �Ա�ʵ�飬̽������������ˮ������ ���������ڲ�ͬ�����µ�ˮ��̶ȣ����ԣ����ԣ�����
CH3COONa��C2H5OH �Ա�ʵ�飬̽������������ˮ������ ���������ڲ�ͬ�����µ�ˮ��̶ȣ����ԣ����ԣ�����
��������
�����Ҵ�Ϊԭ������ϩ����Ҫ��Ũ��������������ˮ�����������¶���170�����ҡ�
��Ӧ�Ļ�ѧ����ʽΪCH3CH2OH ![]() CH2=CH2����H2O
CH2=CH2����H2O
����CH3CH2OH ![]() CH2=CH2����H2O��
CH2=CH2����H2O��
��Ϊ��ϩ�п��ܻ���Ũ���Ὣ�Ҵ�̼�������ɵ�SO2������Ӧʹ��NaOH��Һ���ӡ�
��Ϊ��NaOH��Һ��
������������NaOH���Ҵ���Һ��������ϩ��������Ӧ�Ļ�ѧ����ʽΪ
CH3CH2Br��NaOH![]() CH2=CH2����NaBr+ H2O��
CH2=CH2����NaBr+ H2O��
����CH3CH2Br��NaOH![]() CH2=CH2����NaBr+ H2O��
CH2=CH2����NaBr+ H2O��
��Ȼ����������ˮ��ĸ���Ӧ�������ﲻ������ϩ�����У���������ֻ��Ϊ�Ҵ������ܼ��ӷ����£�����ˮ�����Ҵ�����Ϊ��ˮ��
�����ʯ�еμӱ���ʳ��ˮ��������Ӧ�Ļ�ѧ����ʽΪCaC2��2H2O��CH��CH����Ca(OH)2��
����CaC2��2H2O��CH��CH����Ca(OH)2
��Ϊ��ʯ�г�����CaS���ʣ��������ɵ���Ȳ�����г�����H2S���壬��ʹ������ͭ��Һ��������Ϊ��CuSO4��Һ��
��1���Թܢ���Ϊ���������������������µ�ˮ�ⷴӦ����Ӧ��ȫ����Ӧ�Ļ�ѧ����ʽ��CH3COOC2H5��NaOH ![]() CH3COONa��C2H5OH��
CH3COONa��C2H5OH��
����CH3COOC2H5��NaOH ![]() CH3COONa��C2H5OH��
CH3COONa��C2H5OH��
��2���Թܢ���δ�Ӵ���������������ˮ�ⷴӦ������Ϊ�Ա�ʵ���õġ�
��Ϊ���Ա�ʵ�飬̽������������ˮ��������
��3�������������֪�����������ڼ�����������ȫˮ�⣻��ʵ������ķ�����֪�������������²���ˮ�⣻��ˮ��Һ�У���������ˮ��̶Ⱥ�С�����ԣ�ʵ����������������ڲ�ͬ�����µ�ˮ��̶ȣ����ԣ����ԣ�����
��Ϊ�����������ڲ�ͬ�����µ�ˮ��̶ȣ����ԣ����ԣ����ԡ�


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ļס��ҡ������ֽ������ֱ�����������������������ͬ��ϡ������ȫ��Ӧ�����ɣ�2�۵������Σ����������������뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��������˵����ȷ����

A. ���ֽ����Ļ��˳��Ϊ�ף��ң���
B. ��Ӧ�����������������һ����ͬ
C. ���ֽ��������ԭ�������Ǽף��ң���
D. ���ȷ�Ӧ�꣬�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��C��H��O����Ԫ����ɣ���Է�������Ϊ90����4.5 g A��ȫȼ�յIJ�������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����2.7 g��6.6 g��A����NaHCO3��Һ����CO2����������A֮����ˮ��������Ԫ��״������й�A��˵����ȷ����
A. �л���A�ķ���ʽΪC3H8O3
B. 0.1 mol A������Na��Ӧ����2.24 L H2
C. A�������IJ��ﲻ�ܷ���������Ӧ
D. A����һ�������·������۷�Ӧ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ��Ӧ����ʵ���ҽ������ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
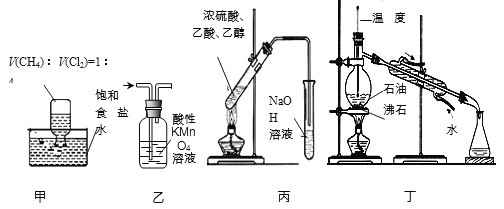
A����װ�ü��ڹ�����������֤�����������ķ�Ӧ
B����װ���ҳ�ȥ��������������ϩ�ô�������
C����װ�ñ���ȡ���ռ���������
D����װ�ö�����ʯ�Ͳ��ռ�60��150�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ�����
Ԫ�� | �����Ϣ |
T | TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��� |
W | W��Tͬ���ڣ�������һ��δ�ɶԵ��� |
X | Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ��mol-1��I2=1817kJ��mol-1��I3=2745kJ��mol-1��I4=11575kJ��mol-1 |
Y | ���³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���� |
Z | Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34 |
��1��TY2��һ�ֳ��õ��ܼ�����__(�������Է����������Ǽ��Է�����)�������д��� ___��![]() ����W������⻯������Һ����������___��
����W������⻯������Һ����������___��
��2����25�桢101kPa�£���֪13.5g��X���嵥����O2����ȫȼ�պ�ָ���ԭ״̬������419kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__��
��3����̬Yԭ���У�����ռ�ݵ�����ܲ����Ϊ__�����ܲ���е�ԭ�ӹ����Ϊ___��������Ϊ___��Y������WԪ�صĵ縺���ɴ�С��˳��Ϊ___(��Ԫ�ط�������)��
��4����֪Z�ľ����ṹ��ͼ��ʾ����֪Z���ܶ�Ϊ9.00g��cm-3�����߳�Ϊ___��
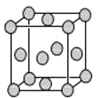
ZYO4�������Һ������YO42-�Ŀռ乹����__������Yԭ�ӵ��ӻ����������___��Z�ĵ���������������е������Լ�������Ӧ�����ɳ����Z+HCl+O2=ZCl+HO2��HO2(������![]() ������һ���������Ҳ��һ�����ɻ������м��ߵĻ��ԡ�����˵�����ʾ��ȷ����__��
������һ���������Ҳ��һ�����ɻ������м��ߵĻ��ԡ�����˵�����ʾ��ȷ����__��
A.O2�������� B.HO2����������
C.HO2�ڼ������ȶ����� D.1molZ�μӷ�Ӧ��1mol���ӷ���ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.���ݷ��������������ſ�Ԥ���л�����������ʡ�
(1)���л������У��������ױ�������������_____(����ĸ)��
a.�� b.�ױ� c.������ d.����
(2)���л��������ܷ�����ȥ��Ӧ����_____(����ĸ)��
a.���״� b. (CH3)3CCl c. (CH3)2CHOH d. ![]()
��.��Ҫ��д�����з�Ӧ�Ļ�ѧ����ʽ��
(1)(CH3)2C(OH)CH(OH)CH2OH ������������Ӧ��_____��
(2)1,2-������鷢����ȥ��Ӧ��������_____��
(3)����ȩ����������Ӧ��_____��
��.��д����������������ͬ���칹�壬�������������칹��
(1)����ʽΪ C6H12O2 ������ NaOH ��Һ����ˮ�ⷴӦ���л��ﹲ��_____�֡�
(2)����ʽΪ C8H8Cl2 �ұ������� 3 ��ȡ�������л��ﹲ��_____�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��״���£�ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�![]() ����
����
(1)ʵ�����п���ϡ�������������ϡ��Һ��Ӧ���ⶨ�к��ȡ���д���ܱ�ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ ______ ��
(2)�ֱ�ȡ100mL![]() ������100mL
������100mL![]() NaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��������������������Һ���ܶȶ���
NaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��������������������Һ���ܶȶ���![]() ���кͺ�������Һ�ı�����
���кͺ�������Һ�ı�����![]() ʵ��ʱ����÷�Ӧǰ������NaOH��Һ��ƽ���¶�Ϊ
ʵ��ʱ����÷�Ӧǰ������NaOH��Һ��ƽ���¶�Ϊ![]() ����Ӧ������Һ���¶�Ϊ
����Ӧ������Һ���¶�Ϊ![]() ��ʵ���õ��к���
��ʵ���õ��к���![]() ______
______ ![]() ����1λС��
����1λС��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X��������ѧ��ѧ�г��������ʣ���ת����ϵ��ͼ��ʾ�����X�������ǣ� ��
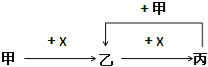
A. ��ΪC��XΪO2 B. ��ΪSO2��XΪNaOH��Һ
C. ��ΪFe��XΪCl2 D. ��ΪAlCl3��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ч��������״����2019��nCoV�ĸ�Ⱦ����ṹ��ͼ��ʾ�����й��ڸ����ʵ�˵����ȷ���ǣ� ��
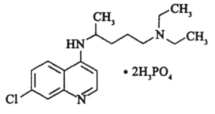
A.������Nԭ�Ӿ�Ϊsp2�ӻ�
B.������ֻ����1������̼ԭ��
C.�ܷ���ȡ����Ӧ����ȥ��Ӧ
D.1mol��������������4molH2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com