
【题目】含有一定量NaOH溶液中,逐渐通入一定量 CO2,充分反应后,将溶液在一定条件下进行蒸干,得到晶体物质。其质量m 与通入气体体积V(CO2)的关系如图。如下说法正确的是
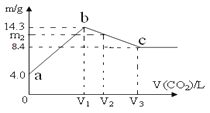
A.晶体物质:a点是NaOH;b点是Na2CO3;c点是NaHCO3
B.a→b 和 b→c 两段过程得到的晶体,含有相同的晶体物质
C.整个过程中的溶液,一定存在恒等式:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-)
D.若通入V2=1.344 L (标况) 气体,则m2=13.12 g
【答案】BD
【解析】
A.由图可知,随二氧化碳的通入,得到固体的质量先增大后减小,最后不变,氢氧化钠完全转化为碳酸钠、碳酸氢钠,生成碳酸氢钠时固体的质量更大,则b为Na2CO3·10H2O,c点是NaHCO3,开始未通入二氧化碳,故a点是NaOH,故A错误;
B.由A分析可知,a→b发生氢氧化钠与二氧化碳反应生成碳酸钠,b点恰好反应,该段得到的晶体为氢氧化钠与碳酸钠晶体,b→c发生碳酸钠与二氧化碳反应生成碳酸氢钠,c点时恰好反应,该段得到的晶体为碳酸氢钠与碳酸钠晶体,都含有碳酸钠晶体,故B正确;
C.在碳酸钠溶液和碳酸氢钠溶液中均存在电荷守恒关系c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故C错误;
D.V2=1.344L时,氢氧化钠与二氧化碳完全反应,生成碳酸钠与碳酸氢钠,二氧化碳的物质的量为![]() =0.06mol,由图可知氢氧化钠为4g,物质的量为
=0.06mol,由图可知氢氧化钠为4g,物质的量为![]() =0.1mol,令碳酸钠与碳酸氢钠分别为xmol、ymol,由碳原子守恒有x+y=0.06,由钠离子守恒有2x+y=0.1,联立方程,解得x=0.04,y=0.02,m2表示碳酸钠晶体与碳酸氢钠的质量之和,故m2=0.04mol×286g/mol+0.02mol×84g/mol=13.12g,故D正确;
=0.1mol,令碳酸钠与碳酸氢钠分别为xmol、ymol,由碳原子守恒有x+y=0.06,由钠离子守恒有2x+y=0.1,联立方程,解得x=0.04,y=0.02,m2表示碳酸钠晶体与碳酸氢钠的质量之和,故m2=0.04mol×286g/mol+0.02mol×84g/mol=13.12g,故D正确;
故选BD。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。某研究小组欲用以下三种方案制备ClO2,回答下列问题:
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
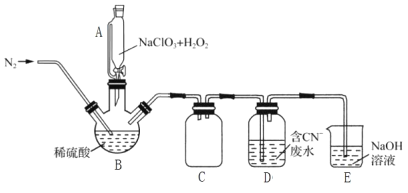
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
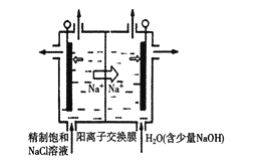
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
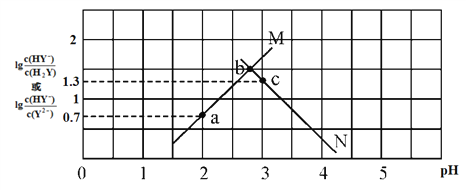
A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”, 煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图所示:下列说法不正确的是

A、该化合物的分子式为:C30H30O8
B、1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C、在一定条件下,可与乙酸反应生成酯类物质
D、该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B,C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:

(1)写出三个装置中所共同发生的两个反应的化学方程式:_____;_____。写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:_____。
(2)装置A和C均采用了长玻璃导管,其作用是_____。
(3)按装置B,C装好仪器及药品后要使反应开始,应对装置B进行的操作是_____;应对装置C进行的操作是____。
(4)装置B,C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_____。
(5)B中采用了洗气瓶吸收装置,其作用是____,反应后洗气瓶中可能出现的现象是_____。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g)![]() WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空。
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是_____,_________,________,______。

实验编号 | ①中的物质 | ②中的物质 |
1 | 淀粉碘化钾溶液 | 浓硝酸 |
2 | 酚酞溶液 | 浓硫酸 |
3 | 氯化铝溶液 | 浓氨水 |
4 | 湿润的红纸 | 饱和氯水 |
(2)用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
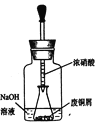
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题。
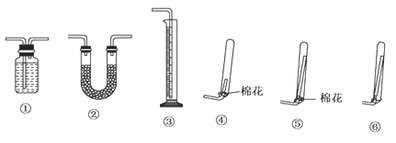
①若要测定生成的NH3的体积,则必须选择的装置是______(填装置序号),装置中所盛试剂应具有的性质是_______,收集干燥的NH3,收集装置应选择(填装置序号)_______,理由是__________。
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式_______。
(4)下图是苯与溴发生反应并进行产物检验的反应装置:

实验装置中的冷凝管“左低右高”的放置目的是____________,整套实验装置中能防止倒吸的装置是_____(填装置序号)。
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)________。
(6)如果要验证③是否成立的实验方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+C12![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2= CH2+ C12![]()
![]()
C.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com