
【题目】I.丙烯和乙烯都是石油化工最重要的基础原料。主要工业生产途径如下:
途径①CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径②nCH3OH(g)![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9kJ/mol、2056.5 kJ/mol和285.8 kJ/mol,则△H1=_____ kJ/mol。
(2)途径①制备丙烯,要提高丙烯的产率最好采用______条件。(填“高压”或“低压”)
(3)途径②控制适当的条件(温度、压强、催化剂等)可以调节N[N=n(乙烯)/n(丙烯)]在0~1.5之间变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是__________。
②在体积为V的反应器中加入一定量的甲醇,反应1h后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
II:(4)含硫煤燃烧产生SO2,利用尿素[CO(NH2)2]水解的溶液可以吸收空气中的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)
①氨基甲酸铵会与空气中的SO2和O2反应生成(NH4)2SO4,该反应的化学方程式为________。
②-定条件下,用尿素水解液吸收空气中的SO2,测得SO2的吸收率随溶液的温度变化如图甲所示。温度高于60℃时,SO2的吸收率逐渐升高的原因是________。

③尿素溶液吸收SO2的吸收率随溶液的pH变化如图乙所示。尿素深液吸收空气中的SO2后,溶液的pH会降低,为提高SO2的吸收率和充分回收产物,最好向溶液中加入______(填溶液的名称)并控制pH为_______。
【答案】 +122.4 低压 使用高选择性催化剂 75% 2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑ 温度升高,尿素水解生成氨基甲酸铵更快 氨水 6
【解析】(1)对应的热化学方程式为:①C3H8(g)+5O2 (g)=3CO2(g)+4H2O(l) △H3=-2219.9 kJ·mol-1、②H2(g)+1/2O2(g)=H2O(l) △H4=-285.8 kJ·mol-1、③ C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H5=-2056.5 kJ·mol-1,①-②-③可得:CH3CH2CH3(g)=CH2=CHCH3(g)+H2(g) △H1=△H3-△H4-△H5,所以△H1=△H3-△H4-△H5=-2219.9 kJ·mol-1+285.8 kJ·mol-1+2056.5 kJ·mol-1= +122.4 kJ·mol-1。(2)CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率;(3)①有些催化剂具有化学选择性,只能催化某一个反应,使该反应成为最主要的反应,从而提高特定的产物在所有产物中的比例。②当生产的乙烯和丙烯的物质的量之比为1:1时,发生的反应的方程式为5CH3OH
CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率;(3)①有些催化剂具有化学选择性,只能催化某一个反应,使该反应成为最主要的反应,从而提高特定的产物在所有产物中的比例。②当生产的乙烯和丙烯的物质的量之比为1:1时,发生的反应的方程式为5CH3OH![]() C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
5CH3OH![]() C2H4+C3H6+5H2O △n
C2H4+C3H6+5H2O △n
5 1+1+5-5=2
x 0.64×106/32×30%=6×103
所以有=![]() ,解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。(4)①氨基甲酸铵会与空气中的SO2和氧气反应生成(NH4)2SO4,而H2NCOONH4被氧化为二氧化碳,则反应的化学方程式为:2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑。②尿素水解放热,常温下水解反应较慢,温度升高,尿素水解生成氨基甲酸铵的速率加快,使得SO2的吸收率升高。③根据图乙可知,溶液的pH>6时,SO2的吸收率较高,则需要控制在6左右,需要加入碱性物质调节溶液的PH,为了不引入新杂质,可以选用氨水进行调节。
,解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。(4)①氨基甲酸铵会与空气中的SO2和氧气反应生成(NH4)2SO4,而H2NCOONH4被氧化为二氧化碳,则反应的化学方程式为:2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑。②尿素水解放热,常温下水解反应较慢,温度升高,尿素水解生成氨基甲酸铵的速率加快,使得SO2的吸收率升高。③根据图乙可知,溶液的pH>6时,SO2的吸收率较高,则需要控制在6左右,需要加入碱性物质调节溶液的PH,为了不引入新杂质,可以选用氨水进行调节。


科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,利用回收的某酸性锌锰干电池,处理可得到多种化工原料,并制备ZnSO4·7H2O。经查询该电池一种一次性电池,外壳为金属锌铁合金,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的填充物,放电过程产生MnOOH。
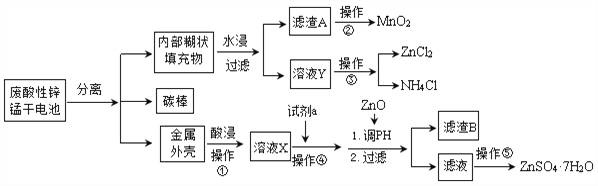
已知:Ksp(Zn(OH)2)=10-17;Ksp(Fe(OH)3)=10-39;![]()
![]() = 4.64 lg2 = 0.3
= 4.64 lg2 = 0.3
回答下列问题:
(1)操作①的酸浸选用的酸为__________(填化学式),溶液X含有的阳离子为_________。
(2)滤渣A进行操作②得到较纯的MnO2,最简便的方法为__________,其原理是________。
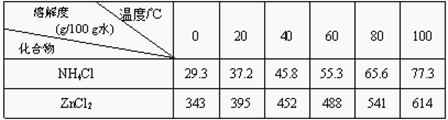
(3)操作③和操作⑤,可通过__________、过滤、洗涤、晾干等步骤,分离提纯得到产品。
(4)操作④选用的试剂a选用___________(填化学式),其目的是______________________________(用离子方程式表示),继续加 ZnO调节pH,生成氢氧化铁沉淀,铁刚好沉淀完全的pH约为________ (离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是_______________________(用离子方程式和必要的文字说明);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(![]() )由大到小的顺序为_______________;(填数字序号)
)由大到小的顺序为_______________;(填数字序号)
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈_____性,溶液中c(Na+)_____c(CH3COO-) (填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)向300mL1mol/L氢氧化钠溶液中通入4.48LCO2(标准状况),充分反应后,所得溶液中存在的物料守恒关系式为:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.乙烯使酸性高锰酸钾溶液褪色
C.将苯滴入少量到溴水中,振荡后水层接近无色
D.乙烯使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com