
由正丁醇(用n?C4H9OH表示)制备正溴丁烷(沸点:101.6 ℃)的反应如下:n?C4H9OH+NaBr+H2SO4―→n?C4H9Br+NaHSO4+H2O
副反应:n?C4H9OH CH3CH2CHCH2↑+H2O
CH3CH2CHCH2↑+H2O
2n?C4H9OH (n?C4H9)2O+H2O
(n?C4H9)2O+H2O
3H2SO4(浓)+2NaBr(固)=2NaHSO4+Br2↑+SO2↑+2H2O
已知反应物及其用量:固体NaBr 0.24 mol,n?C4H9OH 0.20 mol,浓H2SO4 29 mL,H2O 20 mL。
制备过程经历如下五个步骤,试回答下列问题:
(1)投料:在圆底烧瓶中加入20 mL水,再慢慢加入29 mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20 mol正丁醇(约18 mL)和0.24 mol溴化钠,充分振荡后加入几粒沸石。
①冷却至室温后再加正丁醇和溴化钠的目的是________。
A.减少HBr的挥发
B.防止正丁醇的挥发
C.防止溴化钠被氧化
D.防止温度过高导致炭化结焦
②本反应中硫酸与溴化钠作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷。硫酸的用量和浓度过大都对本制备不利的主要原因是
_____________________________________________________。
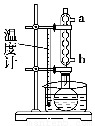
(2)加热回流:反应装置选择Ⅱ而不选择Ⅰ的原因是_________________。在反应装置中冷凝水应该从________(填“A”或“B”)端进水。

(3)分离粗产物:反应结束待反应液冷却后,用直形冷凝管换下球形冷凝管,将其变为蒸馏装置进行蒸馏,得到的粗产物中除主产品外,还含下列选项中的________。
①C4H9OH ②SO2 ③(C4H9)2O ④Br2 ⑤NaHSO4 ⑥H2O ⑦H2SO4
(4)洗涤粗产物:将馏出液移至分液漏斗中,加入等体积的水洗涤后,分液得有机层。如果不能判断哪层是有机层,可以用_______________方法来判断。对有机层,进行洗涤除杂、除水后可得到粗产品。
(5)收集产物:将干燥好的产物移至小蒸馏瓶中,加热蒸馏,收集99~103 ℃的馏分。要证明最终产物是n?C4H9Br,方法是_____________________________
___________________________________________。
(1)①ABC ②会加大副反应进行
(2)Ⅱ可以防止挥发性尾气进入空气污染环境 B (3)①③④⑥
(4)从任意一层取少量溶液加水,如混溶则该层为水层;不混溶则为有机层(其他合理答案也给分)
(5)测定产品的沸点(其他合理答案也给分)
【解析】 (1)①由于浓硫酸与水混合放出大量的热会导致HBr和正丁醇的大量挥发影响原料的利用率,且温度较高时容易发生其他副反应。②硫酸的用量和浓度过大也会导致副反应的发生。(2)装置Ⅰ和Ⅱ的主要区别是有无尾气吸收装置,故应选择Ⅱ可以防止挥发性尾气进入空气污染环境。冷凝管中冷凝水从下口进入可以使冷却更加充分。(3)反应结束后混合液中含有产品以及未完全反应的反应物和反应中的一些副产物,但SO2为气体已脱离该体系;然后再进行蒸馏,一些易挥发的物质都随主产品一同蒸馏出来。(4)该题充分利用水和有机层互不相溶的特点来解题。(5)测定物质的沸点是比较准确的判断物质组成的方法。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过________mol·L-1。
,则吸入肺部CO的浓度不能超过________mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
T/℃ | K1 | K2 | K3 |
700 | 1.47 | 2.38 | 0.62 |
900 | 2.15 | 1.67 |
|
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)??CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
A.缩小容器体积 B.降低温度 C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
下列解释事实的方程式不准确的是( )。
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32—+H2O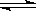 HCO3—+OH-
HCO3—+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:填空题
分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是____________________。
(2)F组中物质除了Cl2外还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:
______________________________________________________________。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,用离子方程式说明理由:_______________________________________________________。
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体
①该红褐色胶体中Z(OH)3粒子的直径大小范围是______________。
②FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )。
A.二氧化硅的分子式:SiO2
B.聚乙烯的结构简式:CH2CH2
C.高氯酸钠(NaClO4)中Cl元素的化合价:+6
D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下:


阿司匹林(乙酰水杨酸)的钠盐易溶于水。阿司匹林可按如下步骤制取和纯化:
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解。
步骤2:按图所示装置装配好仪器,通水,在水浴上加热回流5~10 min,控制水浴温度在85~90 ℃。
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、抽滤、冷水洗涤2~3次,继续抽滤得粗产物。
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤。
步骤5:将滤液倒入10 mL 4 mol·L-1盐酸,搅拌,将烧杯置于冰浴中冷却,使结晶完全。抽滤,再用冷水洗涤2~3次。
(1)步骤1浓硫酸的作用可能是________。
(2)步骤2中,冷凝管通水,水应从________口进(填“a”或“b”)。
(3)步骤3抽滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是______________________________________________________________。
(4)步骤4发生主要反应的化学方程式为_____________________;过滤得到的固体为________。
(5)取几粒步骤5获得的晶体加入盛有5 mL水的试管中,加入1~2滴1%三氯化铁溶液,发现溶液变紫色,可采用________方法,进一步纯化晶体。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
用氯化铁浸出?重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[w(Fe)],实验步骤如下:
步骤1:称取试样0.100 g于250 mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100 mL,迅速塞上胶塞,用电磁搅拌器搅拌30 min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500 mL,再移取100 mL稀释液于锥形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应为Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤6:重复测定两次。
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为________________,迅速塞上胶塞的原因是______________________________
(2)步骤3中判断滤纸上残渣已洗净的方法是_____________________________
(3)实验中需用到100 mL浓度约为0.01 mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有________________。称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是________(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于________(填仪器名称)中。
(4)科研人员为确定FeCl3溶液的最佳浓度,选用100 mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示。则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为________g·L-1,浓度过低或过高时测定结果偏低的原因分别是_________________________。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
下列实验操作正确的是( )。
A.用100 mL容量瓶配制50 mL 0.1 mol·L-1 H2SO4溶液
B.中和热测定的实验中使用的玻璃仪器只有2种
C.分液漏斗、滴定管、容量瓶在使用前均需检查是否漏水
D.漂白粉能露置在空气中保存
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练专题11实验仪器使用及基本操作练习卷(解析版) 题型:选择题
下列实验过程中出现的异常情况,其可能原因分析错误的是( )。
选项异常情况可能原因分析
A蒸发结晶:蒸发皿破裂将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部
B分液:分液漏斗中的液体难以滴下没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
C蒸馏:冷凝管破裂冷凝管没有通水或先加热后通水
D萃取:液体静置不分层加入萃取剂的量较多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com